Thuỷ phân este đơn chức (phương pháp & bài tập hay)
Cách giải bài toán thủy phân Este đơn chức
| – Trong môi trường axit: Phản ứng xảy ra thuận nghịch
RCOOR’ + HOH $\underset{{}}{\overset{{{H}^{+}},{{t}^{0}}}{\longleftrightarrow}}$ RCOOH + R’OH – Trong môi trường kiềm (phản ứng xà phòng hoá): Phản ứng một chiều, cần đun nóng RCOOR’ + NaOH $\xrightarrow{{{t}^{0}}}$ RCOOH + R’OH
|
Một số nhận xét hay về bài toán thủy phân
1) Nếu nNaOH phản ứng = nEste ⇒ Este đơn chức.
2) Nếu RCOOR’ (este đơn chức), trong đó R’ là C6H5- hoặc vòng benzen có nhóm thế
⇒ nNaOH phản ứng = 2neste và sản phẩm cho 2 muối, trong đó có phenolat:
VD: RCOOC6H5 + 2NaOH -> RCOONa + C6H5ONa + H2O
3) Nếu nNaOH phản ứng = α.neste (α > 1 và R’ không phải C6H5- hoặc vòng benzen có nhóm thế) ⇒ Este đa chức.
4) Nếu phản ứng thuỷ phân este cho 1 anđehit (hoặc xeton), ta coi như ancol (đồng phân với andehit) có nhóm –OH gắn trực tiếp vào liên kết C=C vẫn tồn tại để giải và từ đó ⇒ CTCT của este.
5) Nếu sau khi thủy phân thu được muối (hoặc khi cô cạn thu được chất rắn khan) mà mmuối = meste + mNaOH thì este phải có cấu tạo mạch vòng (lacton):
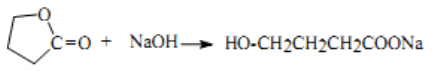
6) Nếu ở gốc hidrocacbon của R’, một nguyên tử C gắn với nhiều gốc este hoặc có chứa nguyên tử halogen thì khi thủy phân có thể chuyên hóa thành andehit hoặc xeton hoặc axit cacboxylic
VD: C2H5COOCHClCH3 + NaOH $\xrightarrow{{{t}^{0}}}$ C2H5COONa + CH3CHO
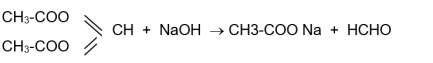
7) Bài toán về hỗn hợp các este thì nên sử dụng phương pháp trung bình.
Bài tập thủy phân Este đơn chức có đáp án chi tiết
| Câu 1: Thực hiện phản ứng xà phòng hoá chất hữu cơ X đơn chức với dung dịch NaOH thu được một muối Y và ancol Z. Đốt cháy hoàn toàn 2,07 gam Z cần 3,024 lít O2 (đktc) thu được lượng CO2 nhiều hơn khối lượng nước là 1,53 gam. Nung Y với vôi tôi xút thu được khí T có tỉ khối so với không khí bằng 1,03. CTCT của X là:
A. C2H5COOCH3 B. CH3COOC2H5 C. C2H5COOC3H7 D. C2H5COOC2H5 |
Lời giải chi tiết
• Theo đề bài: X đơn chức, tác dụng với NaOH sinh ra muối và ancol ⇒ X là este đơn chức: RCOOR’.
• Mặt khác: ${{m}_{X}}+{{m}_{{{O}_{2}}}}={{m}_{C{{O}_{2}}}}+{{m}_{{{H}_{2}}O}}\Rightarrow 44.{{n}_{C{{O}_{2}}}}+18.{{n}_{{{H}_{2}}O}}$= 2,07 + (3,024/22,4).32 = 6,39 g
Và $44.{{n}_{C{{O}_{2}}}}-18.{{n}_{{{H}_{2}}O}}=1,53gam\Rightarrow {{n}_{C{{O}_{2}}}}=0,09\ mol\ ;\ {{n}_{{{H}_{2}}O}}=0,135\ mol$
${{n}_{{{H}_{2}}O}}<{{n}_{C{{O}_{2}}}}$→ Z là ancol no, đơn chức, mạch hở có công thức: CnH2n+1OH (n ≥ 1)
• Từ phản ứng đốt cháy Z
Y có dạng: CxHyCOONa → T: CxHy+1 → MT = 12x + y + 1 = 1,03.29
$\to \left\{ \begin{array} {} x=2 \\ {} y=6 \\ \end{array} \right.$ ⇒ C2H5COOC2H5 → đáp án D
| Câu 2: Thuỷ phân hoàn toàn 8,8 gam một este đơn chức, mạch hở X với 100 ml dd KOH 1M (vừa đủ) thu được 4,6 gam một ancol Y. Tên gọi của X là:
A. Etyl Fomat B. Etyl Propionat C. Etyl Axetat D.Propyl Axetat
|
Lời giải chi tiết
• Nhìn vào đáp án nhận thấy este X là no đơn chức, mạch hở
• Gọi CTCT este là CnH2n + 1COOCmH2m + 1
nrượu = nKOH = 0,1 mol $\to {{M}_{{{C}_{m}}{{H}_{2m+1}}OH}}=\frac{4,6}{0,1}=46\to 14m+18=46\to m=2\to {{C}_{2}}{{H}_{5}}OH$
neste=nKOH =0,1 mol $\to {{M}_{este}}=\frac{8,8}{0,1}=88\to 14n+74=88\to n=1$→ este là $C{{H}_{3}}COO{{C}_{2}}{{H}_{5}}$
⇒Đáp án C
| Câu 3: Đun nóng 0,1 mol este no, đơn chức mạch hở X với 30 ml dung dịch 20% (D = 1,2 g/ml) của một hiđroxit kim loại kiềm A. Sau khi kết thúc phản ứng xà phòng hoá, cô cạn dung dịch thì thu được chất rắn Y và 4,6 gam ancol Z, biết rằng Z bị oxi hoá bởi CuO thành sản phẩm có khả năng phản ứng tráng bạc. Đốt cháy chất rắn Y thì thu được 9,54 gam muối cacbonat, 8,26 gam hỗn hợp CO2 và hơi nước. Công thức cấu tạo của X là:
A. CH3COOCH3 B. CH3COOC2H5 C. HCOOCH3 D. C2H5COOCH3 |
Lời giải chi tiết
• X là este no, đơn chức, mạch hở : CnH2n+1COOCmH2m+1 ( 0 ≤ n; 1 ≤ m)
• Ta có: nX = nAOH (phản ứng) = nZ = 0,1 mol ⇒ MZ = 14m + 18 = $\frac{4,6}{0,1}=46\Rightarrow m=2$
• Mặt khác:
${{n}_{A}}=\frac{30.1,2.20}{100.\left( {{M}_{A}}+17 \right)}=2.\frac{9,54}{2{{M}_{A}}+60}\Rightarrow {{M}_{A}}=23\to A$là Na ⇒ nNaOH (ban đầu) $=\frac{7,2}{40}=0,18$ mol
$Y\left\{ \begin{array} {} {{C}_{n}}{{H}_{2n+1}}COONa:0,1\text{ mol} \\ {} NaOH\ \ \ \ \ \ d-:0,18-0,1=0,08\text{ mol} \\ \end{array} \right.\xrightarrow{+{{O}_{2}},{{t}^{0}}}\left\{ \begin{array} {} N{{a}_{2}}C{{O}_{3}} \\ {} C{{O}_{2}} \\ {} {{H}_{2}}O \\ \end{array} \right.$
• Vậy: ${{m}_{Y}}+{{m}_{{{O}_{2}}}}\left( p/- \right)={{m}_{N{{a}_{2}}C{{O}_{3}}}}+{{m}_{C{{O}_{2}}}}+{{m}_{{{H}_{2}}O}}$
Hay 0,1(14n+68) + 0,08.40 + $\frac{\left( 3n+1 \right)}{2}.0,1.32$ = 9,54 + 8,26 ⇒ n = 1 ⇒ X : CH3COOCH3
→ đáp án A
