Crom là chất gì? Vị trí, cấu tạo, tính chất, ứng dụng, sản xuất (lý thuyết)
I. VỊ TRÍ VÀ CẤU TẠO CỦA CROM
♦ Crom là kim loại chuyển tiếp, thuộc nhóm VIB, chu kì 4, số hiệu nguyên tử là 24.
♦ Sự phân bố electron vào các mức năng lượng: 1s22s22p63s23p64s13d5
♦ Cấu hình electron nguyên tử: 1s22s22p63s23p63d54s1 hay [Ar] 3d54s1
♦ Biểu diễn cấu hình electron qua ô lượng tử:
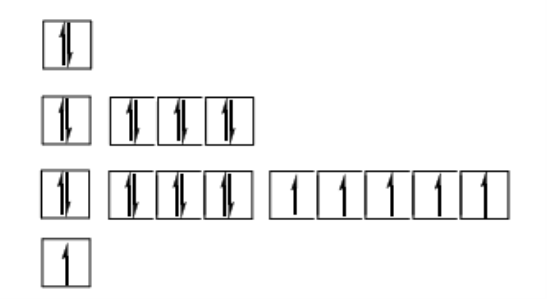
♦ Crom có số oxi hóa +1 đến +6. Phổ biến hơn cả là các số oxi hóa +2, +3 và +6.
♦ Độ âm điện: 1,61
♦ Bán kính nguyên tử Cr 0,13 nm (1 nm = 1×10−9 m = 1×10−3 μm)
♦ Bán kính ion Cr2+ là 0,084 nm và Cr3+ là 0,069 nm.
II. TÍNH CHẤT VẬT LÍ CROM
♦ Crom có màu trắng ánh bạc, rất cứng (cứng nhất trong số các kim loại), khó nóng chảy (18900C).
♦ Crom là kim loại nặng, có khối lượng riêng 7,2 g/cm3.
III. TÍNH CHẤT HÓA HỌC CỦA CROM
1. Tác dụng với phi kim
♦ Ở nhiệt độ cao, crom tác dụng được với nhiều phi kim
4Cr + 3O2 $\xrightarrow{{{t}^{0}}}$ 2Cr2O3
2Cr + 3Cl2 $\xrightarrow{{{t}^{0}}}$ 2CrCl3
2. Tác dụng với nước.
♦ Crom có thế điện cực chuẩn nhỏ ($E_{C{{\text{r}}^{3+}}/C\text{r}}^{0}=-0,74V$) âm hơn so với thế điện cực hidro ở pH = 7 ($E_{{{H}_{2}}O/{{H}_{2}}}^{0}=-0,74V$). Tuy nhiên, trong thực tế crom không phản ứng với nước.
3. Tác dụng với axit
Khi tác dụng với dung dịch HCl, H2SO4 loãng tạo ra muối Cr(II).
Cr không phản ứng với HNO3 và H2SO4 đặc nguội.
Δ Chú ý: Crom không tan được trong dung dịch NaOH loãng cũng như dung dịch NaOH đặc nóng.
IV. ỨNG DỤNG CỦA CROM
- Thép chứa 2,8-3,8% crom có độ cứng cao, bền, có khả năng chống gỉ
- Thép chứa 18% crom là thép không gỉ (thép inox).
- Thép chứa 25-30% crom siêu cứng dù ở nhiệt độ cao.
- Crom dùng để mạ thép. Thép mạ crom bảo vệ kim loại khỏi bị ăn mòn và tạo vẻ đẹp cho đồ vật.
V. SẢN XUẤT CROM NHƯ THẾ NÀO?
- Phương pháp nhiệt nhôm: Cr2O3 được tách ra từ quặng cromit FeO.Cr2O3.
4 FeCr2O4 + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
2 Na2CrO4 + H2SO4 → Na2Cr2O7 + Na2SO4 + H2O
Na2Cr2O7 + 2 C → Cr2O3 + Na2CO3 + CO
Cr2O3 + 2Al $\xrightarrow{{{t}^{0}}}$ 2Cr + Al2O3
