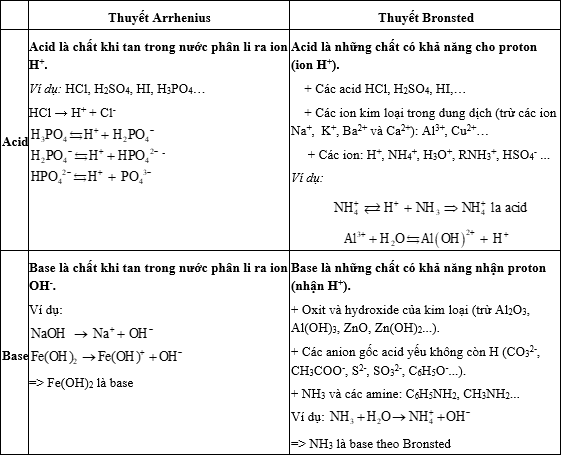
I. Khái niệm acid, base
Bài tập áp dụng:
Bài 1: Theo thuyết Arrhenius, chất nào sau đây là acid?
A. NaOH
B. BaSO4
C. HCl.
D. NaCl
Lời giải: Theo thuyết Arrhenius, acid là chất khi tan trong nước phân li ra ion H+.
\(NaOH\,\, \to \,\,N{a^ + }\,\, + \,\,O{H^ – }\)
$BaS{O_4}\,\, \to \,\,B{a^{2 + }}\,\, + \,\,SO_4^{2 – }$
$HCl\,\, \to \,\,{H^ + }\,\, + \,\,C{l^ – }$
$NaCl\,\, \to \,\,N{a^ + }\,\, + \,\,C{l^ – }$
Vậy HCl là acid.
=> Đáp án: C
Bài 2: Dãy các chất và ion nào sau đây là base?
A. \(CO_3^{2 – },{\mkern 1mu} C{H_3}CO{O^ – },{\mkern 1mu} N{H_3}\)
B. \(CO_3^{2 – },{\mkern 1mu} C{H_3}CO{O^ – },{\mkern 1mu} ZnO\)
C. \(HCO_3^ – ,{\mkern 1mu} C{H_3}CO{O^ – },{\mkern 1mu} HSO_4^ – \)
D. \(Zn{(OH)_2},CO_3^{2 – },{\mkern 1mu} AlO_2^ – \)
Lời giải: Dãy chất và ion là base là $CO_3^{2 – },{\mkern 1mu} C{H_3}CO{O^ – },{\mkern 1mu} N{H_3}$
\(C{O_3}^{2 – }\; + {\text{ }}{H_2}O\; \rightleftarrows \;HC{O_3}^{ – \;} + {\text{ }}O{H^ – }\)
\(C{H_3}CO{O^ – }\; + {\text{ }}{H_2}O \rightleftarrows \;C{H_3}COOH{\text{ }} + {\text{ }}O{H^ – }\)
\(N{H_3}\; + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}N{H_4}^{ + \;} + {\text{ }}O{H^ – }\)
=> Đáp án: A
II. Khái niệm về muối
1. Định nghĩa
Muối là hợp chất khi tan trong nước điện li ra các cation kim loại hoặc \(NH_4^ + \) và anion gốc acid.

Ví dụ:
$KN{O_3}{\mkern 1mu} {\mkern 1mu} \to \,{\mkern 1mu} {K^ + } + {\mkern 1mu} {\mkern 1mu} N{O_3}^ – $
$N{H_4}Cl \to NH_4^ + + C{l^ – }$
2. Phân loại
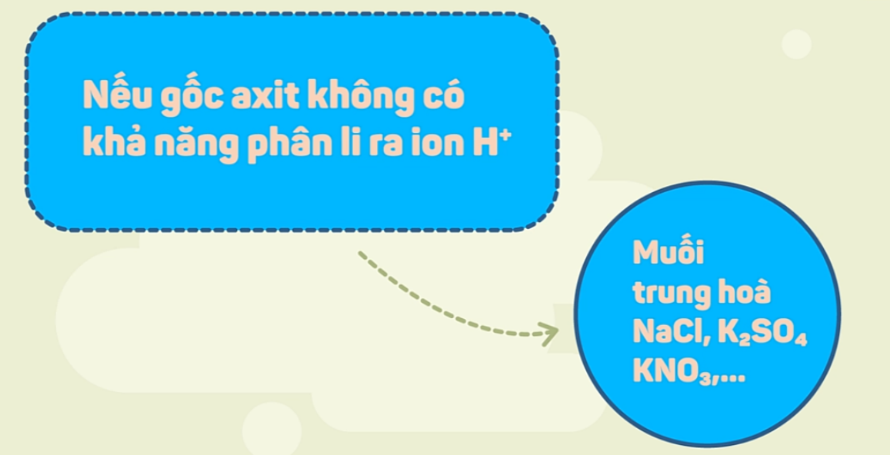
– Muối trung hòa là muối có anion gốc acid không còn hydrogen có khả năng phân li ra ion H+.
Ví dụ: NaCl, CaSO4, K2CO3, NH4NO3…
– Muối acid là muối có anion gốc acid còn hydrogen có khả năng phân li ra ion H+.
Ví dụ: NaHSO3, Ca(HSO4)2, KH2PO4,…

Chú ý: Trong gốc acid của một số muối Na2HPO3, NaH2PO2 vẫn còn hydrogen, nhưng là muối trung hòa vì các hydrogen đó không có tính acid (không phân li ra H+).
Bài tập áp dụng:
Bài 1: Muối là hợp chất khi tan trong nước phân li ra
A. kim loại và anion gốc acid
B. cation kim loại.
C. anion gốc acid.
D. cation kim loại (hoặc NH4+) và anion gốc acid.
Lời giải: Muối là hợp chất khi tan trong nước điện li ra các cation kim loại hoặc $NH_4^ + $ và anion gốc acid.
=> Đáp án: D
Bài 2: Chất nào sau đây là muối acid?
A. Na2CO3.
B. Na2SO4.
C. NaCl.
D. NaHCO3.
Lời giải: Muối acid là muối có anion gốc acid còn hydrogen có khả năng phân li ra ion H+.
Vậy NaHCO3 là muối acid vì khi tan trong nước, NaHCO3 có phương trình điện li là:
\(NaHC{O_3}{\text{ }} \to {\text{ }}N{a^ + }{\text{ }} + {\text{ }}HCO_3^ – \)
\(HCO_3^ – {\text{ }} \leftrightarrows {\text{ }}{H^ + }{\text{ }} + {\text{ }}CO_3^{2 – }\)
=> Đáp án: D
III. Chất lưỡng tính
– Chất lưỡng tính là chất vừa có tính acid, vừa có tính base
+ Hydroxide lưỡng tính: khi tan trong nước vừa có thể phân li như acid vừa có thể phân li như base Zn(OH)2, Al(OH)3, Cr(OH)3,…
Ví dụ: Al(OH)3 là hydroxide lưỡng tính.
- Phân li theo kiểu acid: \(Al{\left( {OH} \right)_3}\;\; \rightleftarrows \;\;Al{O_2}^ – \;{\text{ }}\; + \;{\text{ }}{H^ + }\;{\text{ }}\; + \;{\text{ }}{H_2}O\)
- Phân li theo kiểu base: \(Al{\left( {OH} \right)_3}\;\; \rightleftarrows \;{\text{ }}\;A{l^{3 + }}\;{\text{ }} + \;{\text{ }}3O{H^ – }\)
+ Oxit lưỡng tính: Al2O3, ZnO, Cr2O3,…
+ Muối acid của gốc acid yếu: NaHCO3, NaHS, NaHSO3, Na2HPO4, NaH2PO4…
+ Muối của acid yếu và base yếu: (NH4)2CO3, CH3COONH4,…
Chú ý: Chất lưỡng tính khi phản ứng với acid, base không thay đổi số oxi hóa (chỉ là quá trình nhường nhận proton, không có sự trao đổi electron). Do đó, Zn, Al phản ứng với acid, base nhưng không phải chất lưỡng tính vì Al, Zn thay đổi số oxi hóa trong phản ứng.
Bài tập áp dụng: Chất nào sau đây là hydroxide lưỡng tính?
A. Ba(OH)2.
B. Zn(OH)2.
C. Mg(OH)2.
D. NaOH.
Lời giải: Zn(OH)2 là hydroxide lưỡng tính.
- Phân li theo kiểu acid: \(Zn{\left( {OH} \right)_2}\;\; \rightleftarrows \;\;Zn{O_2}^{2 – }\;{\text{ }}\; + \;{\text{ 2}}{H^ + }\;{\text{ }}\;\)
- Phân li theo kiểu base: \(Zn{\left( {OH} \right)_2}\;\; \rightleftarrows \;{\text{ }}\;Z{n^{2 + }}\;{\text{ }} + \;{\text{ }}2O{H^ – }\)
=> Đáp án: B
