I. Khái niệm, tính chất vật lí và ứng dụng của muối nitrate
1. Khái niệm và công thức tổng quát
Muối nitrate là muối của nitric acid, có công thức tổng quát là M(NO3)n.
Ví dụ: sodium nitrate NaNO3, ammonium nitrate NH4NO3.
2. Tính chất vật lí
Tất cả các muối nitrate đều tan và là các chất điện li mạnh:
M(NO3)n → Mn+ + nNO3–
3. Ứng dụng
– Các muối nitrate được sử dụng chủ yếu làm phân bón hóa học (phân đạm): NH4NO3, NaNO3, KNO3, Ca(NO3)2…
– Potassium nitrate còn được sử dụng để điều chế thuốc nổ đen. Thuốc nổ đen chứa 75% KNO3, 10%S và 15%C.

II. Tính chất hóa học của muối nitrate
1. Muối nitrate có các tính chất hóa học chung của muối
– Tác dụng với acid: Ba(NO3)2 + H2SO4 → BaSO4 + 2HNO3
– Tác dụng với dung dịch base: Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3
– Tác dụng với dung dịch muối: Mg(NO3)2 + Na2CO3 → MgCO3 + 2NaNO3
– Tác dụng với kim loại: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
2. Muối nitrate dễ bị nhiệt phân
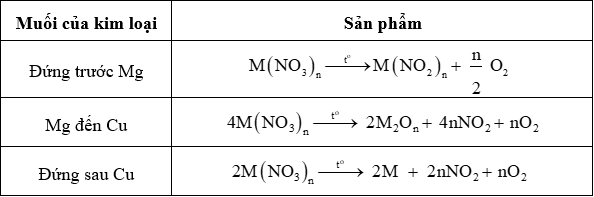
Chú ý: Một số muối nhiệt phân không theo quy luật trên như Fe(NO3)2, NH4NO3…
3. Tính oxi hóa trong môi trường acid
Nếu muối nitrate tồn tại trong môi trường acid thì cũng có tính oxi hóa mạnh như HNO3.
Ví dụ:
3Cu + 8HCl + 2KNO3 → 3CuCl2 + 2KCl + 2NO + 4H2O
III. Bài tập phản ứng nhiệt phân muối nitrate
Muối nitrate đều kém bền: khi đun hoặc nung nóng sẽ bị nhiệt phân.
1. Các phương trình phản ứng nhiệt phân muối nitrate
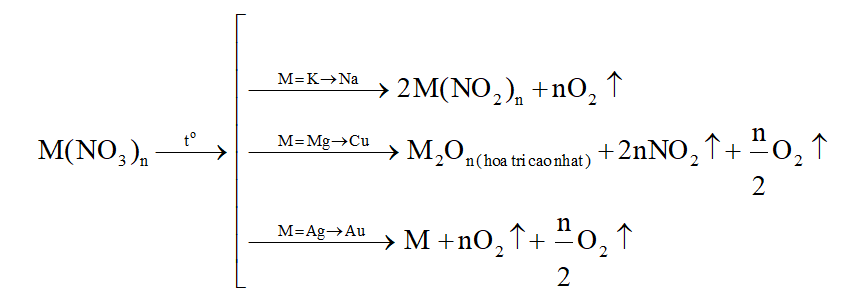
Ví dụ:
\(NaN{O_3}\;\xrightarrow{{{t^o}}}{\text{ }}2NaN{O_2}\; + {\text{ }}{O_2}\)
\(2Cu{\left( {N{O_3}} \right)_2}\;\xrightarrow{{{t^o}}}\;2CuO{\text{ }} + {\text{ }}4N{O_2}\; + {\text{ }}{O_2}\)
\(2AgN{O_3}\;\xrightarrow{{{t^o}}}{\text{ }}2Ag{\text{ }} + {\text{ }}2N{O_2}\; + {\text{ }}{O_2}\)
- Một số phản ứng đặc biệt
(1) \(Ba{(N{O_3})_2}\,\,\xrightarrow{{{t^o}}}\,\,BaO\,\, + \,\,N{O_2}\,\, + \,\,{O_2}\)
(2) Tất cả các phản ứng nhiệt phân muối nitrate đều là phản ứng oxi hóa – khử.
(3) Khi nhiệt phân muối của \(NH_4^ + \):
\(N{H_4}N{O_3}\;\xrightarrow{{{t^o}}}\,\,{N_2}O{\text{ }} + {\text{ }}2{H_2}O\)
\(N{H_4}N{O_2}\;\xrightarrow{{{t^o}}}{\text{ }}{N_2}\; + {\text{ }}2{H_2}O\)
(4) \(2Fe{\left( {N{O_3}} \right)_3}\;\xrightarrow{{{t^o}}}{\text{ }}F{e_2}{O_3}\; + {\text{ }}6N{O_2}\; + {\text{ }}3/2{O_2}\)
2. Phương pháp giải tập phản ứng nhiệt phân muối nitrate
– Thứ tự cân bằng nhanh phản ứng: Kim loại → N → O.
– Khi giải bài tập về phản ứng nhiệt phân muối nitrate lưu ý:
+ Sự tăng giảm khối lượng hoặc bảo toàn khối lượng:
Khối lượng chất rắn giảm bằng khối lượng khí sinh ra:
\({m_{chất\,rắn\,(trước)}}\, – \,{m_{chất\,rắn\,(sau)}}\, = \,\,{m_{khí\,tạo\,thành}}\)
+ Đề bài cho biết tỉ lệ số mol của khí O2 và NO2 sẽ suy ra được loại muối:
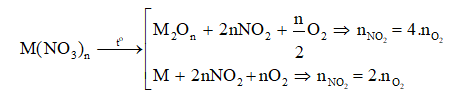
+ Khí sinh ra sau phản ứng thường được dẫn qua nước. Khi đó có phương trình phản ứng:
4NO2 + O2 + 2H2O → 4HNO3
IV. Bài tập phản ứng của muối NO3- trong môi trường acid
– Muối NO3– trong môi trường acid có khả năng oxi hoá như HNO3.
– Dấu hiệu: Kim loại tác dụng với dung dịch hỗn hợp hai acid (H2SO4 loãng và HNO3) hay dung dịch hỗn hợp acid HCl, H2SO4 loãng và muối nitrate.
Ví dụ: Cho Cu vào dung dịch hỗn hợp NaNO3 và H2SO4 loãng sẽ xảy ra phản ứng giải phóng khí sau :
3Cu2+ + 8H+ + 2NO3– → 3Cu2+ + 2NO↑ + 4H2O
Phương pháp giải
– Sử dụng phương trình ion thu gọn hoặc bán phản ứng dạng ion.
– So sánh số mol chất khử, số mol H+, số NO3– để tính toán xem chất nào phản ứng hết, chất nào dư rồi mới tính toán tiếp theo chất phản ứng hết.
– Kết hợp một số phương pháp giải nhanh như: bảo toàn khối lượng, bảo toàn e, bảo toàn nguyên tố.
Bài tập áp dụng: Hoà tan 0,1 mol Cu vào 120ml dung dịch X gồm HNO3 1M và H2SO4 0,5M. Sau khi phản ứng kết thúc thu được V lit khí NO duy nhất. Giá trị của V:
A. 1,344 B. 11,49
C. 0,672 D. 1,12
Lời giải: 3Cu2+ + 8H+ + 2NO3– → 3Cu2+ + 2NO↑ + 4H2O
Ta có \({n_{Cu\,}} = \,0,1\), n\({n_{{H^{ + \,}}}} = \,\,0,24\), \({n_{N{O_3}^ – }}\, = \,0,12\)
=> H+ sẽ hết trước nên số mol khí NO tính theo H+
=> nNO = 0,24 : 4 = 0,06 mol
=> V = 0,06.22,4 =1,344
Đáp án: A
