I. Cấu hình electron ngoài cùng của nguyên tử các nguyên tố nhóm A
– Các nguyên tố thuộc cùng 1 nhóm A có cùng số e lớp ngoài cùng (số e hóa trị) là nguyên nhân của sự giống nhau về tính chất hóa học của các nguyên tố nhóm A.
Số thứ tự của nhóm = số e lớp ngoài cùng = số e hóa trị
– Nguyên tố s thuộc nhóm IA, IIA
– Nguyên tố p thuộc nhóm IIIA, VIIIA
Ví dụ: Vì sao các nguyên tố thuộc cùng 1 nhóm A trong bảng tuần hoàn có tính chất hóa học tương tự nhau?
A. Các nguyên tố có cùng số electron ở phân lớp ngoài cùng
B. Các nguyên tố có cùng số lớp electron
C. Các nguyên tố có số electron hóa trị
D. Các nguyên tố có cùng số electron ở lớp ngoài cùng
Đáp án: D
II. Một số nhóm A tiêu biểu
1. Nhóm VIIIA (nhóm khí hiếm)
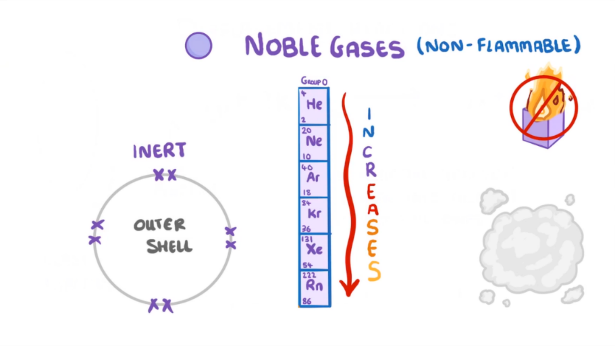
– Gồm các nguyên tố: He, Ne, Ar, Kr, Xe, Rn
– Cấu hình e lớp ngoài cùng chung ns2np6 (trừ He)
– Hầu hết các khí hiếm không tham gia phản ứng hóa học, tồn tại ở dạng khí có 1 nguyên tử.
Ví dụ: Hầu hết các khí hiếm không tham gia phản ứng hóa học, tồn tại ở dạng khí có 1 nguyên tử vì
A. Cấu hình e lớp ngoài cùng của các nguyên tố khí hiếm là ns2np3
B. Cấu hình e lớp ngoài cùng của các nguyên tố khí hiếm là ns2np4
C. Cấu hình e lớp ngoài cùng của các nguyên tố khí hiếm là ns2np5
D. Cấu hình e lớp ngoài cùng của các nguyên tố khí hiếm là ns2np6
Lời giải: Cấu hình e lớp ngoài cùng của các nguyên tố khí hiếm là ns2np6 đã đạt cấu hình bền theo quy tắc bát tử, có 8 electron nên không nhận thêm hay nhường đi số e. Vì vậy hầu hết các khí hiếm không tham gia phản ứng hóa học, tồn tại ở dạng khí có 1 nguyên tử.
=> Đáp án: D
2. Nhóm IA (nhóm kim loại kiềm)
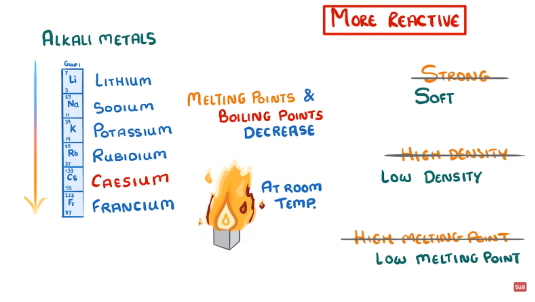
– Gồm các nguyên tố Li, Na, K, Rb, Cs, Fr
– Cấu hình e lớp ngoài cùng: ns1
– Tính chất : dễ nhường 1e để đạt cấu hình bền của khí hiếm
Ví dụ: Trong các phản ứng hóa học, các nguyên tố nhóm IA có xu hướng
A. nhường đi 2 electron.
B. nhường đi 1 electron.
C. nhận thêm 1 electron.
D. nhận thêm 2 electron.
Lời giải: các nguyên tố nhóm IA có cấu hình e lớp ngoài cùng là ns1 nên có xu hướng nhường đi 1 e để đạt cấu hình bền.
=> Đáp án: B
3. Nhóm VIIA (nhóm halogen)
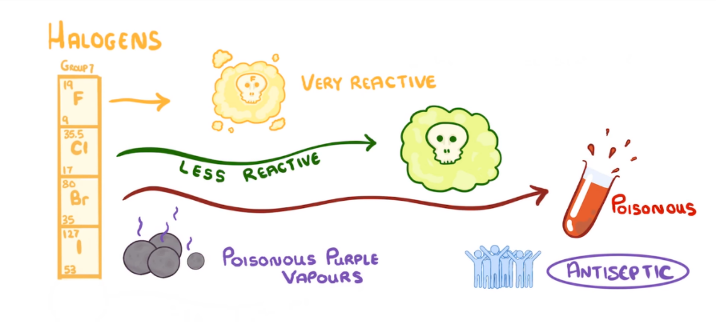
– Gồm các nguyên tố F, Cl, Br, I, At
– Cấu hình e lớp ngoài cùng chung: ns2np5
– Tính chất : dễ nhận 1e để đạt cấu hình bền của khí hiếm
Ví dụ: Trong các phản ứng hóa học, các nguyên tố nhóm VIIA có xu hướng
A. nhận thêm 1 electron.
B. không nhường hay nhận electron.
C. nhận thêm 2 electron.
D. nhường đi 1 electron.
Lời giải: Các nguyên tố nhóm VIIA có cấu hình e lớp ngoài cùng là ns2np5 nên có xu hướng nhận thêm 1 electron để đạt cấu hình bền.
=> Đáp án: A
III. Độ âm điện, bán kính nguyên tử
– Độ âm điện: đặc trưng cho khả năng hút e của nguyên tử đó khi tạo thành liên kết hóa học.
+ Trong cùng 1 chu kì : độ âm điện tăng dần theo chiều tăng điện tích hạt nhân
+ Trong cùng 1 nhóm : độ âm điện giảm dần theo chiều tăng điện tích hạt nhân
+ Cần nhớ thứ tự độ âm điện 4 nguyên tử có độ âm điện lớn nhất: F > O > Cl > N
+ Trong cùng 1 chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần.
Giải thích: Trong cùng 1 chu kì, theo chiều tăng điện tích hạt nhân => độ âm điện tăng => lực hút giữa hạt nhân với e ngoài cùng tăng => bán kính nguyên tử giảm.
– Trong cùng một nhóm A, theo chiều tăng điện tích hạt nhân, bán kính nguyên tử tăng dần.

Giải thích: Trong cùng 1 nhóm. theo chiều tăng điện tích hạt nhân => số lớp e tăng => bán kính nguyên tử tăng.
Ví dụ: Trong một chu kỳ, khi điện tích hạt nhân tăng dần thì
A. bán kính nguyên tử tăng dần, tính phi kim giảm dần.
B. bán kính nguyên tử tăng dần, tính phi kim tăng dần.
C. bán kính nguyên tử giảm dần, tính kim loại tăng dần.
D. bán kính nguyên tử giảm dần, tính phi kim tăng dần.
Lời giải:
Trong một chu kỳ, khi điện tích hạt nhân tăng dần thì bán kính nguyên tử giảm dần, tính phi kim tăng dần.
=> Đáp án: D
IV. Sự biến đổi về hóa trị của các nguyên tố
Trong một chu kì, đi từ trái sang phải, hóa trị cao nhất của các nguyên tố với oxi tăng lần lượt từ 1 đến 7, còn hóa trị với hydrogen của các phi kim giảm từ 4 đến 1.
* Hóa trị đối với hidro = Số thứ tự nhóm – Hóa trị đối với oxi
* Công thức phân tử ứng với các nhóm nguyên tố (R: là nguyên tố)
R2On: n là số thứ tự của nhóm.
RH8-n: n là số thứ tự của nhóm.
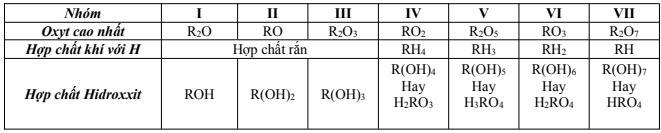
Nhận xét: Hóa trị cao nhất của một nguyên tố với oxygen, hóa trị với hydrogen của các phi kim biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
