I. Thứ tự các mức năng lượng trong nguyên tử
Theo nguyên lí vững bền:
– Các electron nguyên tử ở trạng thái cơ bản lần lượt chiếm các mức năng lượng từ thấp đến cao.

– Khi điện tích hạt nhân tăng, có sự chèn mức năng lượng nên mức năng lượng 4s trở nên thấp hơn 3d, 5s thấp hơp 4d, 6d thấp hơn 4f, 5d…
=> Các phân lớp được sắp xếp theo chiều tăng của năng lượng như sau: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d…
– Thứ tự các lớp electron: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f …
II. Cấu hình electron nguyên tử
1. Cấu hình electron nguyên tử là gì?
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
2. Cách viết cấu hình electron nguyên tử
– Quy ước cách viết cấu hình e
+ STT lớp e được ghi bằng chữ số (1, 2, 3, …)
+ Phân lớp được ghi bằng các chữ cái thường s, p, d, f
+ Số e được ghi bằng số ở phía trên bên phải của phân lớp (s2, p6)
– Một số chú ý khi viết cấu hình e
+ Cần xác định đúng số e của nguyên tử hay ion (số e = số p = Z)
+ Nắm vững các nguyên lí và quy tắc, kí hiệu của lớp và phân lớp
+ Quy tắc bão hòa và bán bão hòa trên d và f: Cấu hình e bền khi các e điền vào phân lớp d và f đạt bão hòa (d10, f14) hoặc bán bão hòa (d5, f7)
– Các bước viết cấu hình e nguyên tử
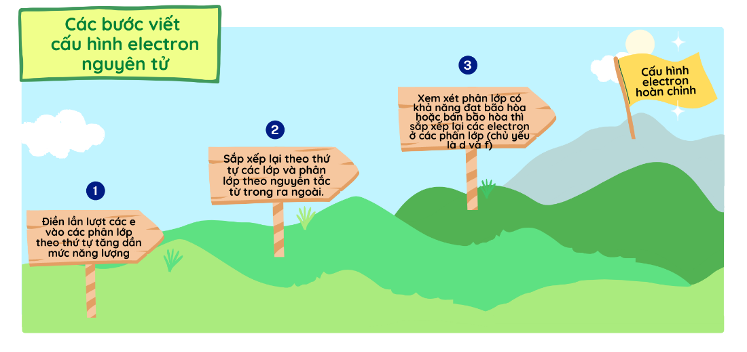
Để xét cấu hình ion, ta dựa vào cấu hình e của nguyên tố đang xét.
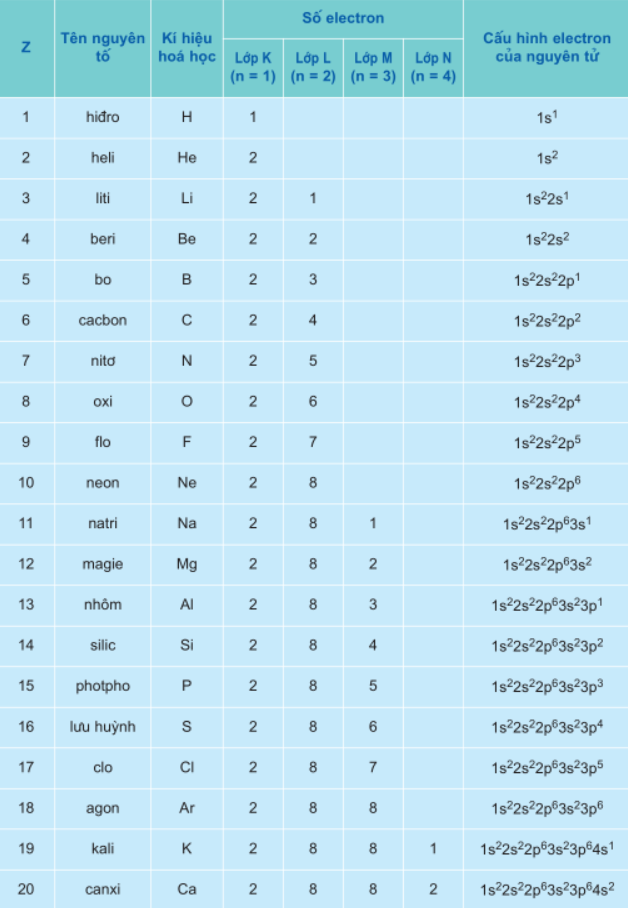
Ví dụ: Viết cấu hình e nguyên tử của các nguyên tố sau:
+ H (Z = 1) : 1s1
+ Ne (Z = 10) : 1s22s22p6
+ Cl (Z = 17) : 1s22s22p63s23p5
Chú ý trường hợp đặc biệt: Các nguyên tố có cấu hình nguyên tử bán bão hòa:
+ Cr (Z = 24) 1s22s22p63s23p63d44s2 chuyển thành 1s22s22p63s23p63d54s1
+ Cu (Z = 29) 1s22s22p63s23p63d94s2 chuyển thành 1s22s22p63s23p63d104s1
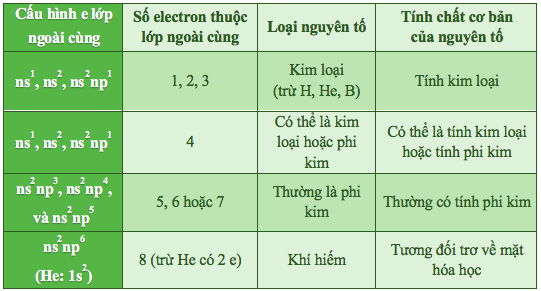
III. Xác định đặc điểm của NTHH dựa vào lớp e ngoài cùng
Bài tập áp dụng:
Cho biết cấu hình electron nguyên tử của các nguyên tố sau:
X là 1s2 2s2 2p6 3s1
Y là 1s2 2s2 2p6 3s2;
Z là 1s2 2s2 2p6 3s2 3p1
T là 1s2 2s2 2p6 3s2 3p5
Q là 1s2 2s2 2p6 3s2 3p6
1. Hãy cho biết những nguyên tố KL và PK?
A. Kim loại: X, Y, Z; Phi kim: T
B. Kim loại: Y, Z, T; Phi kim: Q
C. Kim loại: Z, T, Q; Phi kim: Y
D. Kim loại: X, T, Q; Phi kim: Z
Lời giải:
Số e thuộc lớp ngoài cùng của các nguyên tố là:
X: 1e => Nguyên tố KL
T: 7e => Nguyên tố PK
Y: 2e => Nguyên tố KL
Y: 8e => Nguyên tố khí hiếm
Z: 3e => Nguyên tố KL
=> Đáp án: A
2. Nguyên tố nào có thể nhận 1 electron trong các phản ứng hóa học?
A. Q B. T
C. X D. Z
Lời giải: T là nguyên tố PK có cấu hình electron lớp ngoài cùng 3s2 3p5 nên có thể nhận 1 electron trong các phản ứng hóa học để đạt cấu trúc bền vững của khí hiếm.
=> Đáp án: B
IV. Xác định NTHH dựa vào đặc điểm số e trong mỗi phân lớp

Ví dụ: Một nguyên tử X có tổng số electron ở phân lớp p là 11. Nguyên tố X là :
A. Nguyên tố s. B. Nguyên tố p.
C. Nguyên tố d. D. Nguyên tố f.
Lời giải:
X có tổng số e ở phân lớp p là 11
=> Các phân lớp p có chứa e của X là: 2p6, 3p5.
Vì ở lớp 3, phân lớp 3p chưa bão hòa => 3p là phân lớp ngoài cùng của X
=> X là nguyên tố p
=> Đáp án: C
Nếu đề bài yêu cầu tìm NTHH bằng cách cho biết số e ở phân lớp s hoặc p, ta viết cấu hình electron nguyên tử, sau đó xác định được NTHH dựa vào đặc điểm số e ở mỗi phân lớp.
Ví dụ: Một nguyên tử Y có tổng số electron ở phân lớp s là 7. Nguyên tố X là :
A. Calcium (Ca) B. Barium (Ba)
C. Magnesium (Mg) D. Potassium (K)
Lời giải:
Y có tổng số electron ở phân lớp s là 7
=> Các phân lớp p có chứa e của Y là: 1s2, 2s2, 3s2, 4s1.
Vì phân lớp 4s chưa bão hòa => 4s là phân lớp ngoai cùng của nguyên tố Y
=> Cấu hình electron của nguyên tố Y là: 1s22s22p63s23p64s1
Y là Potassium (K)
=> Đáp án: D
