I. Phản ứng oxi hoá khử
1. Chất oxi hóa, chất khử
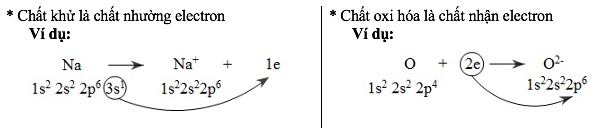
– Quá trình nhường electron gọi là quá trình oxi hóa (hay sự oxi hóa)
– Quá trình nhận electron gọi là quá trình khử (sự khử)

2. Phản ứng oxi hóa – khử
– Khái niệm: Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự chuyển electron giữa các chất phản ứng.
– Dấu hiệu nhận biết: có sự thay đổi số oxi hóa của 1 hay nhiều nguyên tố
Ví dụ 1: Sodium cháy trong khí oxi tạo sodium oxide
\(4\mathop {Na}\limits^0 \,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,\mathop {{O_2}}\limits^0 \,\,\,\,\,\,\,\,\xrightarrow{{{t^o}}}\,\,\,\,\,\,\,\,2\mathop {N{a_2}}\limits^{ + 1} \mathop O\limits^{ – 2} \)
chất khử chất oxi hóa
Ví dụ 2:
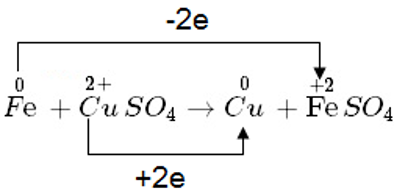
– Nguyên tử Fe nhường electron => là chất khử
– Ion Cu2+ nhận electron => là chất oxi hóa
– Khử cho – o nhận (chất khử cho e, chất oxi hóa nhận e)
– Chất tạo môi trường trong phản ứng oxi hóa khử là chất không tham gia cho nhận e. Chất tạo môi trường đôi khi quyết định đến sản phẩm của phản ứng.
Bài tập áp dụng:
Ví dụ 1: Phản ứng oxi hóa – khử là phản ứng
chỉ xảy ra sự nhận e. B. chỉ xảy ra sự cho e.
có kèm theo sự thay đổi số oxi hóa. D. không thay đổi số oxi hóa các chất.
Lời giải: Phản ứng oxi hóa – khử là phản ứng có kèm theo sự thay đổi số oxi hóa.
Đáp án: C
Ví dụ 2: Trong các phản ứng sau, phản ứng nào HCl đóng vai trò là chất oxi hoá?
A. $4HCl\,\,\, + \,\,\,\,Mn{O_2}\,\,\, \to \,\,\,MnC{l_2}\,\,\, + \,\,\,C{l_2} \uparrow \,\,\, + \,\,\,2{H_2}O$
B. $4HCl\,\,\, + \,\,\,2Cu\,\,\, + \,\,\,{O_2}\,\, \to \,\,\,2CuC{l_2}\,\,\, + \,\,\,2{H_2}O$
C. $2HCl\,\,\, + \,\,\,Fe\,\,\, \to \,\,\,FeC{l_2}\,\,\, + \,\,\,{H_2} \uparrow $
D. $16HCl\,\,\, + \,\,\,2KMn{O_4}\,\,\, \to \,\,\,2MnC{l_2}\,\, + \,\,\,5C{l_2}\,\,\, + \,\,\,8{H_2}O\,\, + \,\,\,2KCl$
Lời giải: Đóng vai trò là chất oxi hóa ⇒ giảm số oxi hóa
– Phản ứng A và D: $2\mathop {Cl}\limits^{ – 1} \,\,\,\,\,\,\,\,\,\,\, \to \,\,\,C{l_2}\,\,\, + \,\,\,\,2e$
Số oxi hóa của Clo tăng => HCl là chất khử và là chất tạo môi trường
– Phản ứng B không làm thay đổi số oxi hóa của HCl
– Phản ứng C: $2\mathop H\limits^{ + 1} \,\,\,\, + \,\,\,\,2e\,\,\,\, \to \,\,\,\,\,{H_2}$
⇒ H từ +1 → 0 số oxi hóa giảm => HCl là chất oxi hóa
=> Đáp án: C
Ví dụ 3: Trong phản ứng: \(3Cu\,\, + \,\,8HN{O_3}\,\, \to \,\,3Cu{(N{O_3})_2}\,\, + \,\,2NO\,\, + \,\,4{H_2}O\,\) có 2 phân tử HNO3 là chất oxi hóa còn 6 phân tử là môi trường.
II. Phương pháp cân bằng phản ứng oxi hoá khử
Nguyên tắc bảo toàn electron:

Ví dụ: Lập phương trình hóa học của phản ứng sau: \(F{e_2}{O_3}\,\, + \,\,CO\,\,\xrightarrow{{{t^o}}}\,\,Fe\,\, + \,\,C{O_2}\)
Bước 1: Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi
${\mathop {Fe}\limits^{ + 3} _2}{O_3}\,\,\, + \,\,\,\mathop C\limits^{ + 2} O\,\,\xrightarrow{{{t^o}}}\,\,\,\mathop {Fe}\limits^0 \,\,\, + \,\,\,\mathop C\limits^{ + 4} {O_2}$
Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình
$\mathop C\limits^{ + 2} \,\,\, \to \,\,\mathop C\limits^{ + 4} \,\,\, + \,\,2e$ (quá trình oxi hóa)
$\mathop {Fe}\limits^{ + 3} \,\,\, + \,\,\,3e\,\,\, \to \,\,\,\mathop {Fe}\limits^0 $ (quá trình khử)
Bước 3: Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tống số electron mà chất oxi hóa nhận
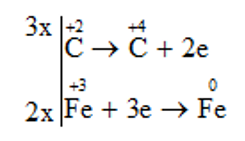
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học
$F{e_2}{O_3}\,\,\, + \,\,\,3CO\,\,\, \to \,\,\,\,2Fe\,\,\, + \,\,\,3C{O_2}$
III. Phân loại phản ứng oxi hoá khử
1. Phản ứng oxi hóa – khử thông thường: chất khử và chất oxi hóa ở 2 phân tử chất khác nhau
Ví dụ: \(\mathop {Fe}\limits^0 \,\,\, + \,\,\,\mathop {Cu}\limits^{ + 2} \,\,\, \to \,\,\mathop {Fe}\limits^{ + 2} S{O_4}\,\, + \,\,\mathop {Cu}\limits^0 \)
2. Phản ứng oxi hóa – khử nội phân tử: chất khử và chất oxi hóa thuộc cùng 1 phân tử nhưng ở 2 nguyên tử khác nhau (thường là phản ứng nhiệt phân)
Ví dụ: \(2AgN{O_3}\,\,\, \to \,\,\,2Ag\,\,\, + \,\,\,2N{O_2}\,\,\, + \,\,\,{O_2}\)
3. Phản ứng tự oxi hóa – khử, chất khử đồng thời cũng là chất oxi hóa (thuộc cùng 1 nguyên tố)
Ví dụ: \(C{l_2}\,\, + \,\,\,2NaOH\,\,\, \to \,\,\,NaCl\,\,\, + \,\,\,NaClO\,\,\, + \,\,\,{H_2}O\)
IV. Ý nghĩa của phản ứng oxi hoá khử trong thực tiễn
Phản ứng oxi hóa – khử là phản ứng hóa học khá phổ biến trong tự nhiên và có tầm quan trọng trong đời sống và sản xuất.

