Trắc nghiệm Hóa học 12 Bài 11: Nguồn điện hoá học
Phần 1. Trắc nghiệm Nguồn điện hoá học
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Trong quá trình hoạt động của pin điện Cu-Ag, điện cực đồng
A. là điện cực dương.
B. là cathode.
C. là điện cực bị giảm dần khối lượng.
D. là nơi xảyra quá trình khử.
Hướng dẫn giải
Đáp án đúng là: C
Trong pin điện hóa Cu-Ag thì cực âm là Cu (anode), xảy ra quá trình oxi hóa:
Cu → Cu2+ + 2e
Do đó, bị giảm dần khối lượng.
Câu 2: Trong quá trình hoạt động của pin điện hoá Zn-Cu, nhận định nào sau đây không đúng về vai trò của cầu muối?
A. Ngăn cách hai dung dịch chất điện li.
B. Cho dòng electron chạy qua.
C. Trung hoà điện ở mỗi dung dịch điện li.
D. Đóng kín mạch điện.
Hướng dẫn giải
Đáp án đúng là: B
Trong quá trình pin hoạt động, cầu muối cho phép các ion di chuyển qua, do đó vừa đóng kín mạch điện, vừa duy trì tính trung hòa điện của mỗi dung dịch.
Câu 3: Sức điện động chuẩn của pin điện hoá H2–Cu (gồm hai điện cực ứng với hai cặp oxi hoá – khử là 2H+/H2 và Cu2+/Cu) đo được bằng vôn kế có điện trở vô cùng lớn là 0,340V. Từ đó, xác định được thế điện cực chuẩn của cặp Cu2+/ Cu là
A. -0,340 V.
B. 0,000 V.
C. 0,680 V.
D. +0,340 V.
Hướng dẫn giải
Đáp án đúng là: D
Epin = E°cathode – E°anode
Câu 4: Phản ứng hoá học xảy ra trong pin điện hoá Sn-Cu:
Trong quá trình hoạt động của pin điện hoá, nhận định nào sau đây là đúng?
A. Khối lượng của điện cực Sn tăng.
B. Nồng độ Sn2+ trong dung dịch tăng.
C. Khối lượng của điện cực Cu giảm.
D. Nồng độ Cu2+ trong dung dịch tăng.
Hướng dẫn giải
Đáp án đúng là: B
Trong quá trình hoạt động của pin điện hoá, phản ứng xảy ra nên nồng độ Sn2+ trong dung dịch tăng.
Câu 5: Một pin điện hoá có điện cực Zn nhúng trong dung dịch ZnSO4 và điện cực Cu nhúng trong dung dịch CuSO4. Sau một thời gian pin đó phóng điện thì
A. khối lượng điện cực Zn giảm còn khối lượng điện cực Cu tăng.
B. khối lượng điện cực Zn tăng còn khối lượng điện cực Cu giảm.
C. khối lượng cả hai điện cực Zn và Cu đều tăng.
D. khối lượng cả hai điện cực Zn và Cu đều giảm.
Hướng dẫn giải
Đáp án đúng là: A
Giải thích:
khối lượng điện cực Zn giảm.
khối lượng điện cực Cu tăng.
Câu 6: Mối liên hệ giữa dạng oxi hoá và dạng khử của kim loại M được biểu diễn ở dạng quá trình khử là
A. M → Mn+ + ne.
B. Mn+ + ne → M.
C. Mn+ → M + ne.
D. M + ne → Mn+.
Hướng dẫn giải
Đáp án đúng là: B
Quá trình khử là quá trình nhận electron: Mn+ + ne → M.
Câu 7: Cho các cặp oxi hoá-khử của các kim loại và thế điện cực chuẩn tương ứng:
Cặp oxi hoá-khử | Li+/Li | Mg2+/Mg | Zn2+/Zn | Ag+/Ag |
Thế điện cực chuẩn, V | -3,040 | -2,356 | -0,762 | +0,799 |
Trong số các kim loại trên, kim loại có tính khử mạnh nhất là
A. Mg.
B. Zn.
C. Ag.
D. Li.
Hướng dẫn giải
Đáp án đúng là: D
Thế điện cực chuẩn càng nhỏ thì dạng khử có tính khử càng mạnh. Vậy kim loại có tính khử mạnh nhất là Li.
Câu 8: Trong pin điện hoá Zn-Cu, phản ứng hoá học xảy ra giữa hai dạng nào của các cặp oxi hoá-khử tương ứng?
A. Zn và Cu2+.
B. Zn và Cu.
C. Zn2+và Cu2+.
D. Zn và Cu2+.
Hướng dẫn giải
Đáp án đúng là: A
Trong pin điện hóa thì:
– Cực âm là Zn (anode), xảy ra quá trình oxi hóa: Zn → Zn2+ + 2e.
– Cực dương(cathode) xảy ra quá trình khử: Cu2+ + 2e → Cu
Câu 9: Trong quá trình hoạt động của pin điện Zn-Cu, dòng electron di chuyển từ
A. cực kẽm sang cực đồng.
B. cực bên phải sang cực bên trái.
C. cathode sang anode.
D. cực dương sang cực âm.
Hướng dẫn giải
Đáp án đúng là: A
Nguyên tắc hoạt động của pin điện hóa: dòng electron di chuyển từ cực âm sang cực dương tạo ra dòng điện hay dòng electron di chuyển từ cực kẽm sang cực đồng.
Câu 10: Trong quá trình hoạt động của pin điện Ni-Cu, quá trình xảy ra ở anode là
A. Ni → Ni2+ + 2e.
B. Cu → Cu2+ + 2e.
C. Cu2+ + 2e → Cu.
D. Ni2+ + 2e → Ni.
Hướng dẫn giải
Đáp án đúng là: A
Trong pin điện hóa Ni-Cu thì cực âm là Ni (anode) xảy ra quá trình oxi hóa:
Ni → Ni2+ + 2e.
Phần II. Câu trắc nghiệm đúng sai. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai. (Đ – S)
Câu 11: Trong quá trình một pin Galvani đang hoạt động.
a) Năng lượng được chuyển đổi từ hoá năng thành điện năng.
b) Xảy ra phản ứng oxi hoá- khử tự diễn biến.
c) Quá trình oxi hoá và quá trình khử xảy ra riêng biệt ở hai điện cực.
d) Sức điện động của pin không thay đổi theo thời gian.
Hướng dẫn giải
a) Đúng.
b) Đúng.
c) Đúng.
d) Sai vì theo thời gian sức điện động của pin giảm do nồng độ của chất tham gia giảm, nồng độ của chất sản phẩm tăng.
Câu 12: Xét pin Galvani tạo bởi hai điện cực kim loại:
a) A là anode, E là cathode, C là cầu muối.
b) Nếu Alà Zn thì B phải là ZnSO4.
c) Nếu C chứa KNO3 thì ion K+ được chuyển từ C vào D.
d) Chiều dòng điện ở mạch ngoài từ A sang E.
Hướng dẫn giải
a) Đúng: Trong pin Galvani thì anode A là thanh Zn, cathode E là thanh Cu.
b) Sai: B có thể là ZnCl2…
c) Đúng: Tại cathode E xảy ra: Cu2+ + 2e →Cu. Nồng độ Cu2+ giảm nên K+ di chuyển vào D để duy trì tính trung hoà điện của D.
d) Sai: chiều dòng điện từ E sang A (ngược với dòng chuyển dời electron).
Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn
Câu 13: Thiết lập pin điện hóa ở điều kiện chuẩn gồm hai điện cực tạo bởi các cặp oxi hóa – khử Ni2+/Ni ( ) và Cd2+/Cd ( ). Sức điện động chuẩn của pin điện hoá trên là bao nhiêu?
Hướng dẫn giải
Đáp án đúng là: +0,146V.
Giải thích:
Epin = E°cathode – E°anode
Câu 14: Lắp ráp pin điện hoá Sn – Cu ở điều kiện chuẩn. Cho biết các giá trị thế điện cực chuẩn: và . Sức điện động của pin điện hóa trên là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm).
Hướng dẫn giải
Đáp án đúng là: +0,48V.
Giải thích:
Do thế điện cực chuẩn của Cu2+/Cu lớn hơn thế điện cực chuẩn của Sn2+/Sn nên anode là Sn, còn cathode là Cu.
Epin = Ecathode – Eanode= 0,34 –(-0,137)= 0,477 V.
Làm tròn tới phần trăm thì suất điện động của pin là +0,48 V.
Câu 15: Hai cặp oxi hoá – khử Ni2+/Ni và Cd2+/Cd tạo thành pin có sức điện động chuẩn là 0,146 V. Phản ứng xảy ra trong pin:
Cd + Ni2+⟶Cd2+ + Ni
Thế điện cực chuẩn của cặp Cd2+/Cd có giá trị là bao nhiêu vôn? (Làm tròn kết quả đến phần trăm)
Cho biết: ở trạng thái chuẩn, pin Ni – Pb có sức điện động 0,131 V;
Hướng dẫn giải
Đáp án đúng là: -0,40V.
Giải thích:
Phản ứng xảy ra trong pin: Cd + Ni2+⟶Cd2+ + Ni
Anode là điện cực ứng với cặp Cd2+/Cd
Cathode là điện cực ứng với cặp Ni2+/Ni
Mà
Lấy (1) + (2) được:
làm tròn -0,40V.
Phần 2. Lý thuyết Nguồn điện hoá học
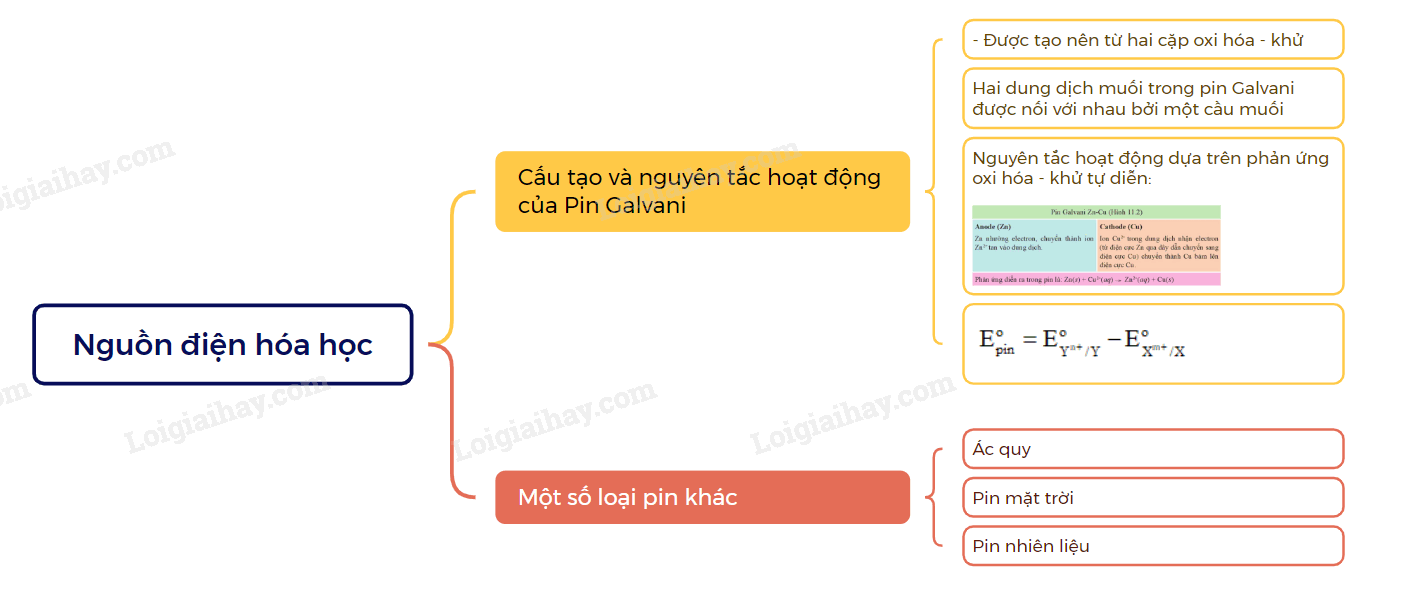
I. Cấu tạo và nguyên tắc hoạt động của Pin Galvani
1. Cấu tạo
Một pin Galvani được tạo nên từ hai cặp oxi hóa – khử khác nhau (ví dụ Cu2+/Cu và Zn2+/Zn, gọi là pin Galvani Zn – Cu) thường có cấu tạo như sau:

Hai dung dịch muối trong pin Galvani được nối với nhau bởi một cầu muối.
2. Nguyên tắc hoạt động
Nguyên tắc hoạt động của pin Galvani dựa trên phản ứng oxi hóa – khử tự diễn biến, trong đó electron chuyển từ cực âm sang cực dương thông qua một dây dẫn điện.
Ví dụ:

3. Sức điện động của pin điện hóa
Sức điện động chuẩn cuẩ pin () tạo từ hai cặp oxi hóa – khử Xm+/X và Yn+/Y (trong đó ) được tính theo công thức sau:
II. Giới thiệu một số loại pin thông dụng khác
1. Acquy
Acquy là một loại pin có thể tái sử dụng nhiều lần bằng cách sạc điện. Acquy thường được phân loại dựa theo bản chất vật liệu làm điện cực.
2. Pin nhiên liệu
Pin nhiên liệu là loại pin biến đổi trực tiếp năng lượng hóa học (hóa năng) thành điện năng nhờ quá trình oxi hóa gián tiếp nhiên liệu diễn ra trong pin. Chất oxi hóa thường dùng trong pin nhiên liệu là oxygen
3. Pin mặt trời
Pin mặt trời là loại pin biến đổi trực tiếp quang năng thành điện năng.
Sơ đồ tư duy Nguồn điện hóa học
Xem thêm các bài Trắc nghiệm Hóa học 12 Cánh diều hay, chi tiết khác:
Trắc nghiệm Bài 10: Thế điện cực chuẩn của kim loại
Trắc nghiệm Bài 11: Nguồn điện hoá học
Trắc nghiệm Bài 12: Điện phân
Trắc nghiệm Bài 13: Cấu tạo và tính chất vật lí của kim loại
Trắc nghiệm Bài 14: Tính chất hoá học của kim loại
Trắc nghiệm Bài 15: Tách kim loại và tái chế kim loại