Câu hỏi:
Làm lạnh 160 gam dung dịch bão hòa muối RSO430% xuống tới nhiệt độ 200C thì thấy có 28,552 gam tinh thể RSO4.nH2O tách ra. Biết độ tan của RSO4ở 20oC là 35 gam. Xác định công thức của tinh thể RSO4.nH2O biết R là kim loại; n là số nguyên và 5 < n < 9.>
A. FeSO4.7H2O.
B. MgSO4.7H2O.
Đáp án chính xác
C.CuSO4.5H2O.
D.ZnSO4.2H2O.
Trả lời:
Bước 1:Tính \({m_{RS{O_4}}}\) ban đầu, mddbão hòa\({m_{RSO4(bd)}} = \frac{{30}}{{100}}.160 = 48(gam)\)- mdd bão hòa(sau khi kết tinh)= 160 – 28,552 = 131,478 gamBước 2:Tính mRSO4mRSO4 ở 20oC, mRSO4mRSO4 trong RSO4.nH2O bị kết tinh- Ở 20oC: SRSO4= 35 gam, ta có:mRSO4(dd 20oC)\( = \frac{{35}}{{135}}.131,478 = 34,087gam\)- Khối lượng RSO4trong RSO4.nH2O bị kết tinh là:mRSO4 (kt)= mRSO4 (ban đầu)– mRSO4 (20 độ)= 48 – 34,087 = 13,913 gamBước 3:Biện luận tìm CTPT của muối ngậm nước- Xét phân tử RSO4.nH2O ta có:\(\frac{{{m_{RSO4}}}}{{{m_{H2O}}}} = \frac{{R + 96}}{{18n}} = \frac{{13,913}}{{28,552 – 13,913}} \to R = 17,142n – 96\)Biện luận: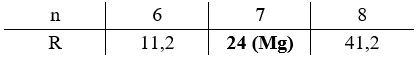 Vậy công thức của muối ngậm nước là MgSO4.7H2O.Đáp án cần chọn là: B
Vậy công thức của muối ngậm nước là MgSO4.7H2O.Đáp án cần chọn là: B
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Dung dịch bão hòa NaNO3ở 10oC có nồng độ 44,44%. Tính độ tan của dung dịch NaNO3ở 10oC. – ĐGNL-HN
Câu hỏi:
Dung dịch bão hòa NaNO3ở 10oC có nồng độ 44,44%. Tính độ tan của dung dịch NaNO3ở 10oC.
A. 44 gam.
B. 80 gam.
C. 60,2 gam.
Đáp án chính xác
D. 50 gam.
Trả lời:
Độ tan của NaNO3là:\(S = \frac{{C{\rm{\% }}}}{{100 – C{\rm{\% }}}}.100 = \frac{{44,44}}{{100 – 44,44}}.100 = 80(g)\)Đáp án cần chọn là: B
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho biết độ tan của NaNO3trong nước ở 200C là 88 gam, còn ở 500C là 114 gam. Khi làm lạnh 642 gam dung dịch NaNO3bão hòa từ 50oC xuống 200C thì có bao nhiêu gam tinh thể NaNO3tách ra khỏi dung dịch? – ĐGNL-HN
Câu hỏi:
Cho biết độ tan của NaNO3trong nước ở 200C là 88 gam, còn ở 500C là 114 gam. Khi làm lạnh 642 gam dung dịch NaNO3bão hòa từ 50oC xuống 200C thì có bao nhiêu gam tinh thể NaNO3tách ra khỏi dung dịch?
A. 64 gam.
B. 88 gam.
C. 78 gam.
Đáp án chính xác
D. 42 gam.
Trả lời:
Bước 1: Tính mNaNO3và mH2Otrong 642gam dd bão hòa NaNO3– Theo đề: SNaNO3(50oC) = 114 gam, ta có:Cứ 214 gam dung dịch bão hòa NaNO3thì có 114 gam NaNO3và 100 gam H2OVậy 642 gam dung dịch bão hòa NaNO3thì có a gam NaNO3và b gam H2O→ a = mNaNO3 = 114.642/214 = 342 gamb = mH2O = 642 – 342 = 300 gam (không đổi)Bước 2: Tính mNaNO3trong 300 gam H2O- Ở 200C: SNaNO3(20oC) = 88 gam, ta có:Cứ 100 gam nước hòa tan tối đa 88 gam NaNO3Vậy 300 gam nước hòa tan tối đa 88.300/100 = 264 gam NaNO3Bước 3: Tính mNaNO3tách ra khỏi dung dịch- mNaNO3 kết tinh = mNaNO3(500C) – mNaNO3(200C)mNaNO3 kết tinh = 342 – 264 = 78 gam.Đáp án cần chọn là: C
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho biết độ tan của NaNO3trong nước ở 200C là 88 gam, còn ở 500C là 114 gam. Khi làm lạnh 642 gam dung dịch NaNO3bão hòa từ 50oC xuống 200C thì có bao nhiêu gamtinh thể NaNO3tách ra khỏi dung dịch? – ĐGNL-HN
Câu hỏi:
Cho biết độ tan của NaNO3trong nước ở 200C là 88 gam, còn ở 500C là 114 gam. Khi làm lạnh 642 gam dung dịch NaNO3bão hòa từ 50oC xuống 200C thì có bao nhiêu gamtinh thể NaNO3tách ra khỏi dung dịch?
A. 64 gam.
B. 88 gam.
C. 78 gam.
Đáp án chính xác
D. 42 gam.
Trả lời:
Bước 1: Tính mNaNO3và mH2Otrong 642gam dd bão hòa NaNO3– Theo đề: SNaNO3(50oC) = 114 gam, ta có:Cứ 214 gam dung dịch bão hòa NaNO3thì có 114 gam NaNO3và 100 gam H2OVậy 642 gam dung dịch bão hòa NaNO3thì có x gam NaNO3và y gam H2O→ x = mNaNO3 = 114.642/214 = 342 gamy = mH2O = 642 – 342 = 300 gam (không đổi)Bước 2: Tính mNaNO3trong 300 gam H2O- Ở 200C: SNaNO3(20oC) = 88 gam, ta có:Cứ 100 gam nước hòa tan tối đa 88 gam NaNO3Vậy 300 gam nước hòa tan tối đa 88.300/100 = 264 gam NaNO3Bước 3: Tính mNaNO3tách ra khỏi dung dịch.- mNaNO3 kết tinh = mNaNO3(500C) – mNaNO3(200C) = 342 – 264 = 78 gam.Đáp án cần chọn là: C
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Hòa tan hoàn toàn 7,2 gam FeO với một lượng vừa đủ dung dịch H2SO4nồng độ 24,5% thu được dung dịch A. Làm lạnh dung dịch A xuống đến 50C thì tách ra được m gam chất rắn (FeSO4.7H2O). Dung dịch còn lại có nồng độ 12,18%. Tính khối lượng m đã tách ra ở trên. – ĐGNL-HN
Câu hỏi:
Hòa tan hoàn toàn 7,2 gam FeO với một lượng vừa đủ dung dịch H2SO4nồng độ 24,5% thu được dung dịch A. Làm lạnh dung dịch A xuống đến 50C thì tách ra được m gam chất rắn (FeSO4.7H2O). Dung dịch còn lại có nồng độ 12,18%. Tính khối lượng m đã tách ra ở trên.
A. 22,24 gam.
Đáp án chính xác
B. 20,85 gam.
C. 23,63 gam.
D. 25,02 gam.
Trả lời:
Bước 1: Tính mdd H2SO4– nFeO = 7,2/ 72 = 0,1 molFeO + H2SO4→ FeSO4+ H2O0,1 0,1 0,1 0,1 (mol)- mH2SO4= 0,1.98 = 9,8 gam→ mdd H2SO4=\(\frac{{9,8.100}}{{24,5}}\) = 40 (gam)Bước 2: Tính số mol FeSO4.7H2O kết tinh- Gọi x là số mol FeSO4.7H2O kết tinh→ mFeSO4 còn lại= mFeSO4 ban đầu– mFeSO4 tách ra= 0,1.152 – 152x = 15,2 – 152x (gam)mdd sau= mFeO+ mdd H2SO4 ban đầu– mFeSO4.7H2O kết tinh= 7,2 + 40 – 278x = 47,2 – 278x (gam)- Ta có nồng độ % của dung dịch còn lại là:\(C{\rm{\% }} = \frac{{{m_{ct}}}}{{{m_{{\rm{dd}}}}}} \times 100{\rm{\% }}\)\( \to \frac{{15,2 – 152x}}{{47,2 – 278x}}.100{\rm{\% }} = 12,18{\rm{\% }}\)→ x = 0,08 molBước 3: Tính m chất rắn FeSO4.7H2O.mFeSO4.7H2O= 0,08.278 = 22,24 gam.Đáp án cần chọn là: A
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Hãy xác định khối lượng tinh thể MgSO4.6H2O tách khỏi dung dịch khi hạ nhiệt độ 1642 gam dung dịch bão hòa MgSO4ở 800C xuống 200C. Biết độ tan của MgSO4ở 80oC là 64,2 gam và ở 20oC là 44,5 gam. – ĐGNL-HN
Câu hỏi:
Hãy xác định khối lượng tinh thể MgSO4.6H2O tách khỏi dung dịch khi hạ nhiệt độ 1642 gam dung dịch bão hòa MgSO4ở 800C xuống 200C. Biết độ tan của MgSO4ở 80oC là 64,2 gam và ở 20oC là 44,5 gam.
A. 601,6 gam.
B. 606,4 gam.
C. 578,8 gam.
D. 624,4 gam.
Đáp án chính xác
Trả lời:
Bước 1: Tính mH2Ovà mMgSO4để tạo thành 1642 gam dd bão hòa.- Ở 800C, SMgSO4= 64,2 gam- Nghĩa là:100 gam H2O hòa tan 64,2 gam MgSO4 tạo thành 164,2 gam dung dịch bão hòaa gam H2O hòa tan b gam MgSO4tạo thành 1642 gam dung dịch bão hòa→ a = 1642.100/164,2 = 1000 gam; b = 64,2.1642/164,2 = 642 gam- Gọi x là số mol MgSO4.6H2O tách ra → Số mol H2O tách ra là 6x mol⟹ Khối lượng H2O tách ra: 108x (g)Khối lượng MgSO4tách ra: 120x (gam)Bước 3: Tính khối lượng tinh thể MgSO4.6H2O kết tinh- Ở 200C, SMgSO4= 44,5 gam- Ta có phương trình: \(\frac{{642 – 120x}}{{1000 – 108x}} = \frac{{44,5}}{{100}}\)Giải ra x = 2,7386 mol- Khối lượng MgSO4.6H2O kết tinh: 228.2,7386 = 624,4 gam.Đáp án cần chọn là: D
====== **** mời các bạn xem câu tiếp bên dưới **** =====
