Câu hỏi:
Hòa tan hết 28,16 gam hỗn hợp rắn X gồm Mg, Fe3O4và FeCO3vào dung dịch chứa H2SO4và NaNO3, thu được 4,48 lít (đktc) hỗn hợp khí Y (gồm CO2, NO, N2, H2) có khối lượng 5,14 gam và dung dịch Z chỉ chứa các muối trung hòa. Dung dịch Z phản ứng tối đa với 1,285 mol NaOH, thu được 43,34 gam kết tủa và 0,56 lít khí (đktc). Mặt khác, cho dung dịch Z tác dụng với lượng dư dung dịch BaCl2 thu được 166,595 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Mg trong X là
A.34,09%.
B.25,57%.
C.38,35%.
Đáp án chính xác
D.29,83%.
Trả lời:
Khi cho dung dịch Z tác dụng với BaCl2dư thì kết tủa thu được là BaSO4\( \to {n_{BaS{O_4}}} = \frac{{166,595}}{{233}} = 0,715\,\,mol\)Bảo toàn gốc \(SO_4^{2 – } \to {n_{{H_2}S{O_4}}} = 0,715\,\,mol\)Khi cho Z tác dụng với NaOH vừa đủ thu được khí là NH3\({n_{N{H_3}}} = \frac{{0,56}}{{22,4}} = 0,025\,\,mol \to {n_{NH_4^ + }} = 0,025\,\,mol\)Bảo toàn điện tích cho dung dịch Z:\(2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} + {n_{N{a^ + }}} = 2{n_{SO_4^{2 – }}}\)Mà \({n_{NaOH}} = 2{n_{M{g^{2 + }}}} + 2{n_{F{e^{2 + }}}} + 3{n_{F{e^{3 + }}}} + {n_{NH_4^ + }} = 1,285\,\,mol\)\( \to 1,285 + {n_{N{a^ + }}} = 2.0,715 \to {n_{N{a^ + }}} = 0,145mol\)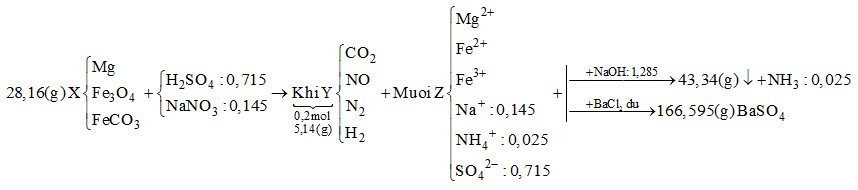 Ta có:\({n_{O{H^ – }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ – }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 1,285 – 0,025 = 1,26\,\,mol\)Bảo toàn khối lượng:\({m_{Fe}} + {m_{Mg}} + {m_{O{H^ – }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\)\( \to {m_{Fe}} + {m_{Mg}} = 21,92g\)Bảo toàn khối lượng cho dung dịch Z:\({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 – }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\)Bảo toàn khối lượng cho phản ứng:\({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\)\( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\)\( \to {m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\)Bảo toàn nguyên tố H :\(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\)\( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\)Đặt số mol của CO2, NO và N2lần lượt là x, y, z\( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\)(*)Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\)\( \to 44x + 30y + 28z = 5,04\)(**)Bảo toàn nguyên tố N :\({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\)\( \to y + 2z = 0,12\)(***)Từ (*), (**) và (***) → x = 0,04; y = 0,01; z = 0,04\( \to {n_{FeC{O_3}}} = 0,04\,\,mol\)Gọi số mol của Mg và Fe3O4lần lượt là a và b\( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\)(1)Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g\( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\)(2)Từ (1) và (2) → a = 0,4; b = 0,06\( \to {\rm{\% }}{m_{Mg}} = \frac{{0.4.24}}{{28,16}}.100{\rm{\% }} = 34,09{\rm{\% }}\)Đáp án cần chọn là: A
Ta có:\({n_{O{H^ – }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} + {n_{NH_4^ + }} = {n_{NaOH}} \to {n_{O{H^ – }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 1,285 – 0,025 = 1,26\,\,mol\)Bảo toàn khối lượng:\({m_{Fe}} + {m_{Mg}} + {m_{O{H^ – }{\kern 1pt} {\kern 1pt} (trong{\kern 1pt} {\kern 1pt} hidroxit)}} = 43,34 \to {m_{Fe}} + {m_{Mg}} + 1,26.17 = 43,34\)\( \to {m_{Fe}} + {m_{Mg}} = 21,92g\)Bảo toàn khối lượng cho dung dịch Z:\({m_{Mg}} + {m_{Fe}} + {m_{Na}} + {m_{NH_4^ + }} + {m_{SO_4^{2 – }}} = 21,92 + 0,145.23 + 0,025.18 + 0,715.96 = 94,345g\)Bảo toàn khối lượng cho phản ứng:\({m_X} + {m_{{H_2}S{O_4}}} + {m_{NaN{O_3}}} = {m_Z} + {m_Y} + {m_{{H_2}O}}\)\( \to 28,16 + 0,715.98 + 0,145.85 = 94,345 + 5,14 + {m_{{H_2}O}}\)\( \to {m_{{H_2}O}} = 14,07g \to {n_{{H_2}O}} = 0,615\,\,mol\)Bảo toàn nguyên tố H :\(2{n_{{H_2}S{O_4}}} = 2{n_{{H_2}}} + 4{n_{NH_4^ + }} + 2{n_{{H_2}O}}\)\( \to 2.0,715 = 2{n_{{H_2}}} + 4.0,025 + 2.0,615 \to {n_{{H_2}}} = 0,05\,\,mol\)Đặt số mol của CO2, NO và N2lần lượt là x, y, z\( \to x + y + z + 0,05 = 0,2 \to x + y + z = 0,15\)(*)Tổng khối lượng Y là 5,14 \( \to 44x + 30y + 28z + 0,05.2 = 5,14\)\( \to 44x + 30y + 28z = 5,04\)(**)Bảo toàn nguyên tố N :\({n_{NaN{O_3}}} = {n_{NO}} + 2{n_{{N_2}}} + {n_{NH_4^ + }} \to 0,145 = y + 2z + 0,025\)\( \to y + 2z = 0,12\)(***)Từ (*), (**) và (***) → x = 0,04; y = 0,01; z = 0,04\( \to {n_{FeC{O_3}}} = 0,04\,\,mol\)Gọi số mol của Mg và Fe3O4lần lượt là a và b\( \to 24a + 232b + 116.0,04 = 28,16 \to 24a + 232b = 23,52\)(1)Vì tổng khối lượng của Mg và Fe trong hỗn hợp X là 21,92g\( \to 24a + 56.(3b + 0,04) = 21,92 \to 24a + 168b = 19,68\)(2)Từ (1) và (2) → a = 0,4; b = 0,06\( \to {\rm{\% }}{m_{Mg}} = \frac{{0.4.24}}{{28,16}}.100{\rm{\% }} = 34,09{\rm{\% }}\)Đáp án cần chọn là: A
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho 19,2 gam kim loại M tan trong dung dịch HNO3dư được 4,48 lít NO (đktc, là sản phẩm khử duy nhất). M là – ĐGNL-HN
Câu hỏi:
Cho 19,2 gam kim loại M tan trong dung dịch HNO3dư được 4,48 lít NO (đktc, là sản phẩm khử duy nhất). M là
A.Fe
B.Cu
Đáp án chính xác
C.Zn
D.Mg
Trả lời:
nNO= 0,2 molQuá trình cho – nhận e:\(\mathop M\limits^0 \, \to \mathop M\limits^{ + n} \,\, + \,ne{\rm{\;\;\;\;\;\;}}\,\,\,\,\,\,\,\,{\rm{\;\;\;}}\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)\(\frac{{0,6}}{n}\;\;{\rm{ }}\; \leftarrow \;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;0,6\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}0,6\;{\rm{ }}\; \leftarrow \;{\rm{ }}\;0,2\)\( = >\,\,\frac{{19,2}}{M} = \frac{{0,6}}{n}\,\, = >\,\,M = 32n\)Với n = 2 =>M = 64 =>M là CuĐáp án cần chọn là: B
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Hoà tan hết 5,4 gam kim loại M trong HNO3dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2và N+4là sản phẩm khử của N+5 – ĐGNL-HN
Câu hỏi:
Hoà tan hết 5,4 gam kim loại M trong HNO3dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2và N+4là sản phẩm khử của N+5
A.Fe
B.Al
Đáp án chính xác
C.Zn
D.Mg
Trả lời:
Gọi nNO= x mol; nNO2= y mol
=>nhỗn hợp khí= x + y = 0,4 mol (1)
\(\bar M = \frac{{30x + 46y}}{{x + y}} = 21.2\)(2)
Từ (1) và (2) =>x = 0,1; y = 0,3
Quá trình cho – nhận e:
\(\begin{array}{*{20}{c}}{}&{\mathop M\limits^0 \, \to \mathop M\limits^{ + n} \,\, + \,ne;\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O}\\{}&{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + {\rm{\;1}}e \to \mathop {\,N}\limits^{ + 4} \,{O_2}}\end{array}\)
Bảo toàn e: ne cho = ne nhận= 3.nNO+ nNO2= 0,6
\( = >\,\,\frac{{5,4}}{M}.n = 0,6\,\, = >\,\,M = 9n\)
Với n = 3 =>M = 27 =>M là Al
Đáp án cần chọn là: B====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho 11 gam hỗn hợp gồm Al và Fe vào dung dịch HNO3dư được 6,72 lít NO (đktc, là sản phẩm khử duy nhất). Khối lượng của Al và Fe lần lượt là – ĐGNL-HN
Câu hỏi:
Cho 11 gam hỗn hợp gồm Al và Fe vào dung dịch HNO3dư được 6,72 lít NO (đktc, là sản phẩm khử duy nhất). Khối lượng của Al và Fe lần lượt là
A.5,6 gam và 5,4 gam
B.5,4 gam và 5,6 gam
Đáp án chính xác
C.4,4 gam và 6,6 gam
D.4,6 gam và 6,4 gam
Trả lời:
Gọi số mol của Al và Fe lần lượt là x và y mol=>mhỗn hợp= 27x + 56y = 11 (1)Quá trình cho – nhận e:\(Al \to \mathop {Al}\limits^{ + 3} \,\,\,\, + \,\,\,3e{\rm{\;\;\;\;\;\;}}\,\,\,\,\,\,\,\,{\rm{\;\;}}\)\(\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)\(Fe\, \to \mathop {\,Fe}\limits^{ + 3} \,\,\, + \,\,\,3e\)Bảo toàn e: 3.nAl + 3.nFe= 3.nNO=>x + y = 0,3 (2)Từ (1) và (2) =>x = 0,2; y = 0,1=>mAl= 0,2.27 = 5,4 gam; mFe= 0,1.56 = 5,6 gamĐáp án cần chọn là: B
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Hoà tan hết m gam Al vào dung dịch HNO3dư được 0,01 mol NO và 0,015 mol N2O là các sản phẩm khử của N+5. Giá trị của m là – ĐGNL-HN
Câu hỏi:
Hoà tan hết m gam Al vào dung dịch HNO3dư được 0,01 mol NO và 0,015 mol N2O là các sản phẩm khử của N+5. Giá trị của m là
A.5,4 gam
B.2,7 gam
C.1,35 gam
Đáp án chính xác
D.8,1 gam
Trả lời:
Xét quá trình cho – nhận e:\(Al \to \mathop {Al}\limits^{ + 3} \,\, + \,3e{\rm{\;}}\)\({\rm{\;}}\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)\(\,\,\mathop {2N}\limits^{ + 5} \,\,\, + {\rm{\;8}}e \to \mathop {\,{N_2}}\limits^{ + 1} \,O\)Bảo toàn e: 3.nAl= 3.nNO+ 8.nN2O=>nAl = (3.0,01 + 8.0,015) / 3 = 0,05 mol=>m = 0,05.27 = 1,35 gamĐáp án cần chọn là: C
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3đã dùng là – ĐGNL-HN
Câu hỏi:
Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3đã dùng là
A.2M
B.1,2M
C.1,4M
D.13/9M
Đáp án chính xác
Trả lời:
nCu= 0,1 mol
Gọi số mol của NO và NO2lần lượt là x và y mol
Xét quá trình cho – nhận e:
\(Cu \to \mathop {Cu}\limits^{ + 2} \,\, + \,2e\)
\(\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)
\(\mathop N\limits^{ + 5} \,\,\, + {\rm{\;1}}e \to \mathop {\,N}\limits^{ + 4} \,{O_2}\)
Bảo toàn e: 2.nCu= 3.nNO+ nNO2=>3x + y = 0,2 (1)
\({\bar M_X} = \frac{{30x + 46y}}{{x + y}} = 18.2\,\,\,\,(2)\)
Từ (1) và (2) =>x = 1/18 mol; y = 1/30 mol
Bảo toàn nguyên tố N: nHNO3 phản ứng = nNO3 (trong muối)+ nNO+ nNO2= 0,1.2 + 1/18 + 1/30 = 13/45 mol
=>CM HNO3= 13/9 M
Đáp án cần chọn là: D====== **** mời các bạn xem câu tiếp bên dưới **** =====
