Câu hỏi:
Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ. Tổng thể tích khí thoát ra ở cả 2 điện cực (V lít) phụ thuộc vào thời gian điện phân (t giây) theo đồ thị bên. Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là: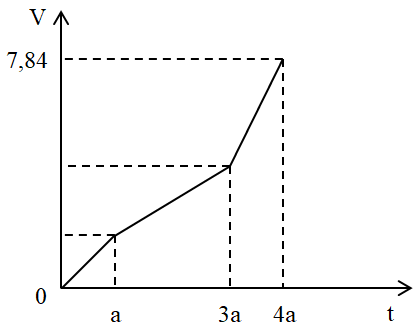
A.31,1
B.29,5
C.31,3
D.30,4
Đáp án chính xác
Trả lời:
Trả lời:Đoạn 1: Chỉ có khí Cl2 thoát ra.Đặt VCl2 = x (lít)Đoạn 2: Chỉ có khí O2 thoát ra. (do khí thoát ra nó thoải hơn so với đoạn 3)Mà ta thấy giá trị V lúc này gấp đôi đoạn tại thời điểm t = a (giây)Do đó VO2 = 2x – x = x (lít)Đoạn 3: Anot có O2 tiếp tục thoát ra. Còn ở catot có H2 thoát ra.Trong đoạn 3 này thời gian bằng nửa đoạn 2 nên VO2 = 0,5x (lít)Bảo toàn electron ta tính được VH2 = x (lít)Tổng cộng 3 đoạn thì khí thoát ra gồm Cl2 (x lít), O2 (1,5x lít) và H2 (x lít)Suy ra x + 1,5x + x = 7,84 → x = 2,24 lítBan đầu: nNaCl =2.nCl2 = 0,2 molTa có: nCu(NO3)2 = nCu = nCl2 + 2.nO2 (đoạn 2) = 0,3 molTại thời điểm t = a (giây): ne trao đổi = 2nCl2 = 2.2,24 : 22,4 = 0,2 molTại thời điểm 3,5a (giây) (thuộc đoạn 3) ta có: ne trao đổi = 3,5. 0,2 = 0,7 molCatot:Cu2+ + 2e → Cu0,3 → 0,6 0,3 molH2O + 2e → H2 + 2OH– 0,1 → 0,05 molAnot:2Cl– -2e → Cl2 0,2 0,2 0,1 mol 2H2O – 4e → O2 + 4H+ 0,5 0,125 molKhi đó thu được 0,3 mol Cu ; 0,05 mol H2 ở catot và 0,1 mol Cl2 và 0,125 mol O2 ở anot.Khối lượng dung dịch giảm chính là khối lượng các chất thoát ra ở các điện cực.Do đó m = mCu + mH2 + mCl2 + mO2 = 0,3.64 + 0,05.2 + 0,1.71 + 0,125.32 = 30,4 (gam)Đáp án cần chọn là: D
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Điện phân dung dịch hồn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là – ĐGNL-HN
Câu hỏi:
Điện phân dung dịch hồn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là
A.6,24 gam.
Đáp án chính xác
B.3,12 gam.
C.6,5 gam.
D.7,24 gam.
Trả lời:
Trả lời:\({n_{{e_{td}}}} = \frac{{5.1930}}{{96500}} = 0,1mol\)Catot gồm Ag+ và Cu2+ bị oxi hóaAg+ + 1e → Ag 0,04 0,04Cu2+ + 2e → Cu 0,06 →0,03\(\left\{ {\begin{array}{*{20}{c}}{{n_{Ag}} = 0,04mol}\\{{n_{Cu}} = \frac{{0,1 – 0,04}}{2} = 0,03mol}\end{array}} \right.\)=>mKL= 0,04.108 + 0,03.64 = 6,24gĐáp án cần chọn là: A
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ, sau t giây thấy catot tăng 5,44 gam. Giá trị của t là – ĐGNL-HN
Câu hỏi:
Điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ, sau t giây thấy catot tăng 5,44 gam. Giá trị của t là
A.2520,5.
Đáp án chính xác
B.1440.
C.1800.
D.1440,5.
Trả lời:
Trả lời:mAg = 4,32g =>mFe(bị điện phân) = 5,44 – 4,32 = 1,12g =>nFe = 0,02 molAg+ + 1e → Ag 0,04 0,04 Fe3++ 1e → Fe2+ 0,06 0,06Fe2+ + 2e → Fe 0,04 0,02=>netđ= 0,04 + 0,1 = 0,14 molMà \({n_{{e_{td}}}} = \frac{{It}}{F} = 0,1molt \Rightarrow t = \frac{{F.{n_{{e_{t{\rm{d}}}}}}}}{I} = \frac{{96500.0,14}}{{5,36}} = 2520,522s\)Đáp án cần chọn là: A
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là: – ĐGNL-HN
Câu hỏi:
Điện phân 500 ml dung dịch hỗn họp FeSO4 0,1M, Fe2(SO4)3 0,2M và CuSO4 0,1M với điện cực trơ. Điện phân cho đến khi khối lượng catot tăng 8,8 gam thì ngừng điện phân. Biết cường độ dòng điện đem điện phân là 10A. Thời gian điện phân là:
A.4583,75 giây.
B.3860 giây.
C.4825 giây.
Đáp án chính xác
D.2653,75 giây.
Trả lời:
Trả lời:nFe3+ = 0,2 mol ; nCu2+ = 0,05mol ; nFe2+ =0,05molmtăng = mCu + mFe =>mFe = 8,8 – 0,05.64 = 5,6g =>nFe = 0,1molCác ion đã điện phân ở catot: Fe3+ , Cu2+, Fe2+ điện phân 1 phầnnetđ = nFe3+ + 2nCu2+ + 2nFe2+ = 0,2 + 0,05.2 + 0,1.2 = 0,5 mol\( \Rightarrow t = \frac{{F.{n_{{e_{t{\rm{d}}}}}}}}{I} = \frac{{96500.0,5}}{{10}} = 4825s\)Đáp án cần chọn là: C
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Điện phân 400ml dd AgNO3 0,2M và Cu(NO3)2 0,1M với cường độ dòng điện I = 10A, anot bằng Pt. Sau thời gian t, ta ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%) – ĐGNL-HN
Câu hỏi:
Điện phân 400ml dd AgNO3 0,2M và Cu(NO3)2 0,1M với cường độ dòng điện I = 10A, anot bằng Pt. Sau thời gian t, ta ngắt dòng điện, thấy khối lượng catot tăng thêm m gam trong đó có 1,28 gam Cu. Thời gian điện phân t là (hiệu suất điện phân là 100%)
A.116 s.
B.1158 s.
Đáp án chính xác
C.772 s.
D.193 s.
Trả lời:
Trả lời:Sinh ra 1,28 g Cu tương đương 0,02 mol Cu mà nCu(NO3)2 = 0,04 >0,02→ Cu(NO3)2 bị điện phân 1 phần → AgNO3 điện phân hếtnAgNO3 = 0,08mol Ag+ + 1e → Ag0,08 → 0,08Cu2+ + 2e → Cu 0,04 0,02=>netđ= 0,04 + 0,08 = 0,12 mol\( \Rightarrow t = \frac{{F.{n_{{e_{t{\rm{d}}}}}}}}{I} = \frac{{96500.0,12}}{{10}} = 1158s\)Đáp án cần chọn là: B
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Điện phân 200 ml dung dịch AgNO3 0,4M và Cu(NO3)2 0,2M với điện cực trơ. Sau một thời gian điện phân lấy catot ra làm khô cân lại thấy tăng m gam, trong đó có 1,28 gam Cu. Giá trị của m là – ĐGNL-HN
Câu hỏi:
Điện phân 200 ml dung dịch AgNO3 0,4M và Cu(NO3)2 0,2M với điện cực trơ. Sau một thời gian điện phân lấy catot ra làm khô cân lại thấy tăng m gam, trong đó có 1,28 gam Cu. Giá trị của m là
A.5,64.
B.7,89.
C.8,81.
D.9,92.
Đáp án chính xác
Trả lời:
Trả lời:Sinh ra 1,28 g Cu tương đương 0,02 mol Cu mà nCu(NO3)2 = 0,04 >0,02→ Cu(NO3)2 bị điện phân 1 phần → AgNO3 điện phân hếtnAgNO3 = 0,08mol Ag+ + 1e → Ag0,08 → 0,08Cu2+ + 2e → Cu 0,04 0,02=>mAg = 0,08.108 = 8,64g=>mcatot tăng = 8,64 + 0,02.64 = 9,92gĐáp án cần chọn là: D
====== **** mời các bạn xem câu tiếp bên dưới **** =====
