Lý thuyết Hóa học 12 Bài 8: Amine
A. Lý thuyết Amine
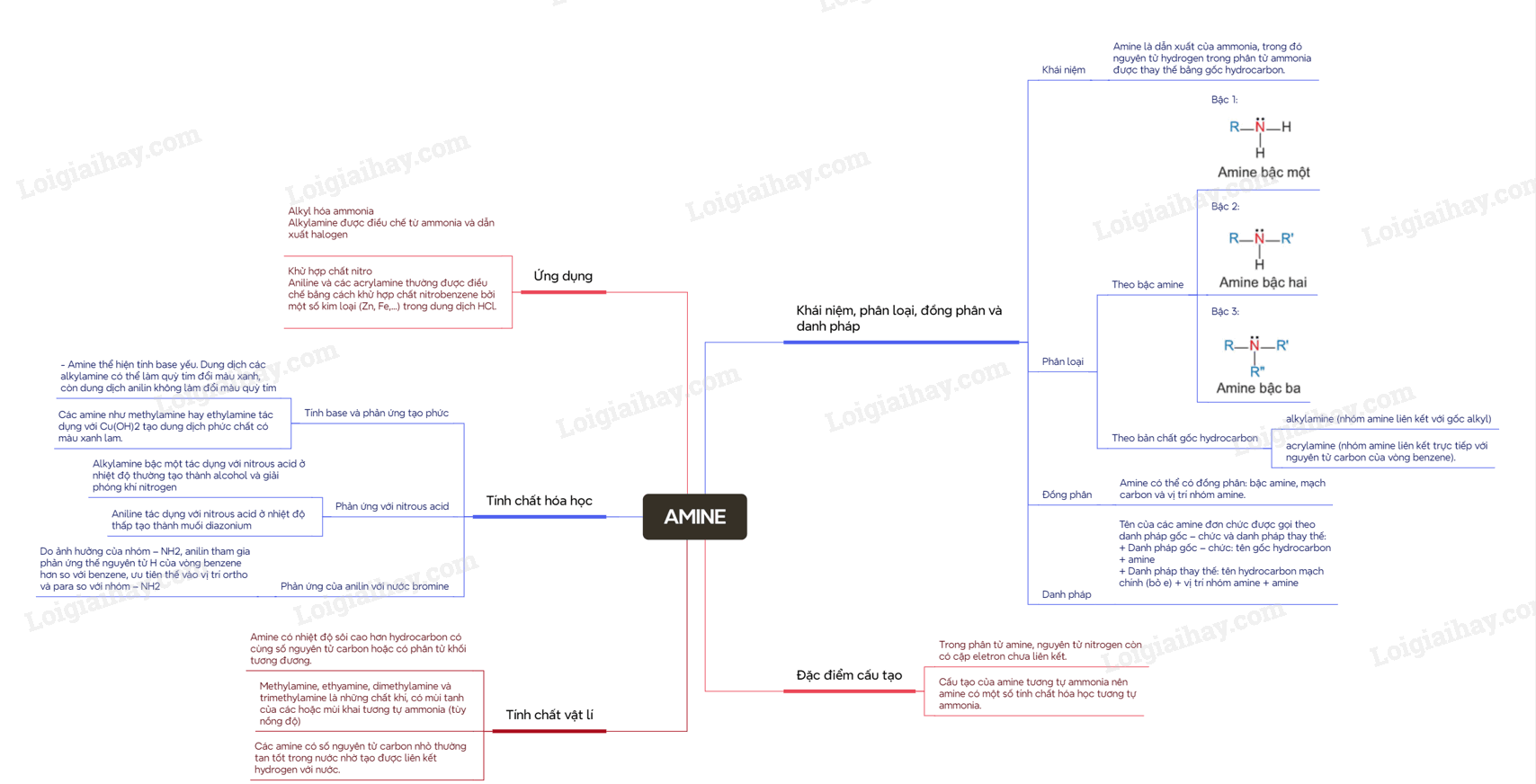
I. Khái niệm, phân loại, đồng phân và danh pháp
1. Khái niệm
Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
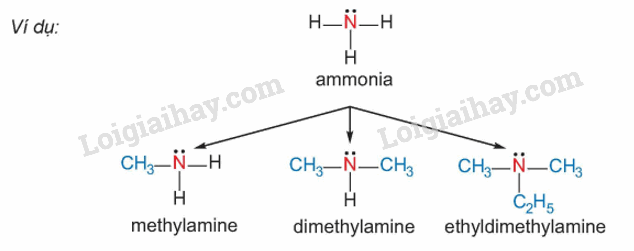
2. Phân loại
Amine thường được phân loại theo bậc của amine và bản chất gốc hydrocarbon
– Bậc của amine được tính bằng số gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
Theo đó được phân loại thành amine bậc một, amine bậc hai và amine bậc ba

– Dựa trên đặc điểm cấu tạo của gốc hydrocaron, amine được phân thành nhiều loại, trong đó hai loại điểm hình là alkylamine (nhóm amine liên kết với gốc alkyl) và acrylamine (nhóm amine liên kết trực tiếp với nguyên tử carbon của vòng benzene).
3. Đồng phân
Các amine có từ hai nguyên tử carbon trong phân tử bắt đầu xuất hiện đồng phân. Amine có thể có đồng phân: bậc amine, mạch carbon và vị trí nhóm amine.
4. Danh pháp
Tên của các amine đơn chức được gọi theo danh pháp gốc – chức và danh pháp thay thế:
+ Danh pháp gốc – chức: tên gốc hydrocarbon + amine
+ Danh pháp thay thế: tên hydrocarbon mạch chính (bỏ e) + vị trí nhóm amine + amine
II. Đặc điểm cấu tạo
Hình dạng phân tử của methylamine và anilin được mô tả như sau:
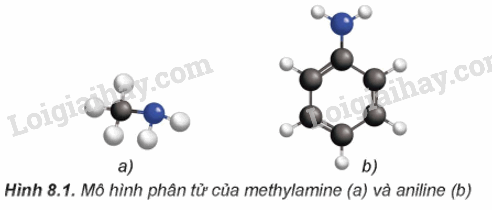
– Trong phân tử amine, nguyên tử nitrogen còn có cặp eletron chưa liên kết. Cấu tạo của amine tương tự ammonia nên amine có một số tính chất hóa học tương tự ammonia.
III. Tính chất vật lí
– Amine có nhiệt độ sôi cao hơn hydrocarbon có cùng số nguyên tử carbon hoặc có phân tử khối tương đương.
– Methylamine, ethyamine, dimethylamine và trimethylamine là những chất khí, có mùi tanh của các hoặc mùi khai tương tự ammonia (tùy nồng độ). Các amine có số nguyên tử carbon nhỏ thường tan tốt trong nước nhờ tạo được liên kết hydrogen với nước.
IV. Tính chất hóa học
1. Tính base và phản ứng tạo phức
– Amine thể hiện tính base yếu. Dung dịch các alkylamine có thể làm quỳ tím đổi màu xanh, còn dung dịch anilin không làm đổi màu quỳ tím

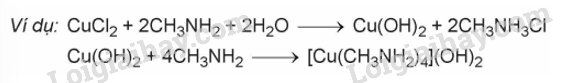
– Các amine như methylamine hay ethylamine tác dụng với Cu(OH)2 tạo dung dịch phức chất có màu xanh lam.
2. Phản ứng với nitrous acid
– Alkylamine bậc một tác dụng với nitrous acid ở nhiệt độ thường tạo thành alcohol và giải phóng khí nitrogen (phản ứng này thường được dùng để nhận biết alkylamine bậc một)
Ví dụ: CH3NH2 + HONO CH3OH + N2 + H2O
– Aniline tác dụng với nitrous acid ở nhiệt độ thấp tạo thành muối diazonium
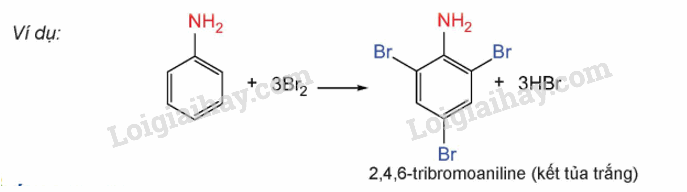
3. Phản ứng của anilin với nước bromine
– Do ảnh hưởng của nhóm – NH2, anilin tham gia phản ứng thế nguyên tử H của vòng benzene hơn so với benzene, ưu tiên thế vào vị trí ortho và para so với nhóm – NH2
V. Ứng dụng
1. Alkyl hóa ammonia
Alkylamine được điều chế từ ammonia và dẫn xuất halogen
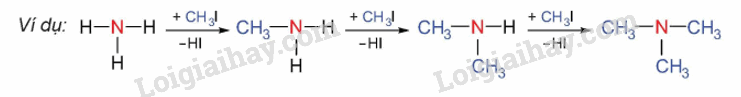
2. Khử hợp chất nitro
Aniline và các acrylamine thường được điều chế bằng cách khử hợp chất nitrobenzene bởi một số kim loại (Zn, Fe,…) trong dung dịch HCl.
![]()
Sơ đồ tư duy Amine
B. Trắc nghiệm Amine
Câu 1. Ethylamine (C2H5NH2) không tác dụng được với chất nào sau đây trong dung dịch?
A. CuSO4.
B. NaOH.
C. HCl.
D. FeCl3.
Hướng dẫn giải
Đáp án đúng là: B
Ethylamine (C2H5NH2) là amine, có tính base nên không tác dụng được với hợp chất có tính base như NaOH.
Câu 2. Khối lượng ethylamine cần để tác dụng vừa đủ với 0,01 mol HCl là
A. 0,31 gam.
B. 0,45 gam.
C. 0,59 gam.
D. 0,90 gam.
Hướng dẫn giải
Đáp án đúng là: B
PTHH: C2H5NH2 + HCl → C2H5NH3Cl
Câu 3. Thuốc thử để phân biện ethylamine và dimethylamine là
A. HNO2.
B. HCl.
C. quỳ tím.
D. FeCl3.
Hướng dẫn giải
Đáp án đúng là: A
Ethylamine là amine bậc một và dimethylamine là amine bậc hai, có thể dụng HNO2 để phân biệt chúng.
Khi cho ethylamine tác dụng nitrous acid thu được khí nitrogen:
C2H5NH2 + HNO2 → C2H5OH + N2↑+ H2O.
Khi cho dimethylamine tác dụng nitrous acid thu được kết tủa CH3N(NO)CH3 màu vàng:
CH3NHCH3 + HNO2 → CH3N(NO)CH3↓ + H2O.
Câu 4. Cho dãy các chất: C2H5NH2, CH3NH2, CH3COOH, CH3–NH–CH3. Số chất trong dãy phản ứng với HCl trong dung dịch là
A. 3.
B. 2.
C. 4.
D. 1.
Hướng dẫn giải
Đáp án đúng là: A
Các chất phản ứng với HCl là C2H5NH2, CH3NH2, CH3–NH–CH3 (đều là các amine, có tính base nên tác dụng với acid).
Câu 5. Trong phân tử chất nào sau đây có chứa vòng benzene?
A. Phenylamine.
B. Propylamine.
C. Ethylamine.
D. Methylamine.
Hướng dẫn giải
Đáp án đúng là: A
Phenylamine có công thức là: C6H5NH2, có chứa vòng benzene trong phân tử.
Câu 6. Chất nào sau đây là amine bậc một?
A. CH3NHC2H5.
B. (CH3)2NH.
C. (C2H5)3N.
D. C6H5NH2.
Hướng dẫn giải
Đáp án đúng là: D
Bậc của amine là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hydrocarbon ⟹ amine bậc một sẽ có dạng RNH2.
Vậy amine bậc một là C6H5NH2.
Câu 7. Hợp chất C2H5NHC2H5 có tên là
A. ethylmethylamine.
B. dimethylamine.
C. propylamine.
D. diethylamine.
Hướng dẫn giải
Đáp án đúng là: D
Hợp chất C2H5NHC2H5 có tên là diethylamine.
Câu 8. Công thức phân tử của ethylamine là
A. C4H11N.
B. CH5N.
C. C3H9N.
D. C2H7N.
Hướng dẫn giải
Đáp án đúng là: D
Ethylamine có công thức là C2H5NH2 hay C2H7N.
Câu 9. Chất nào sau đây là amine bậc hai?
A. H2N−CH2−NH2.
B. (CH3)2CH−NH2.
C. CH3−NH−CH3.
D. (CH3)3N.
Hướng dẫn giải
Đáp án đúng là: C
Bậc của amine là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc hydrocarbon.
Vậy CH3−NH−CH3 là amine bậc hai.
Câu 10. Chất có tính base là
A. CH3NH2.
B. CH3COOH.
C. CH3CHO.
D. C6H5OH.
Hướng dẫn giải
Đáp án đúng là: A
CH3NH2 là amine, có tính base: làm đổi màu quỳ tím sang xanh, đổi màu hồng với chỉ thị phenolphthalein và tác dụng được với các acid.
Câu 11. Amine có thể được phân loại theo bậc amine.
a. Bậc amine bằng số gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen.
b. Theo bậc amine thì amine được chia thành amine bậc một, bậc hai, bậc ba, bậc bốn.
c. CH3NH2 là một amine bậc một.
d. CH3–NH–C2H5 là một amine bậc ba.
Hướng dẫn giải
a. Đúng.
b. Sai vì không có amine bậc bốn.
c. Đúng.
d. Sai vì đây là amine bậc hai.
Câu 12. Cho các amine: CH3NH2, C2H5NH2, C6H5NH2 (C6H5–: phenyl), CH3–NH–CH3, (CH3)3N.
a. Có ba amine bậc một trong số các amine trên.
b. Tất cả các amine trên đều thuộc loại alkylamine.
c. Tên gọi gốc – chức của C2H5NH2 là ethylamine.
d. Tên gọi thay thế của amine CH3–NH–CH3 là N-methylmethanamine.
Hướng dẫn giải
a. Đúng gồm CH3NH2, C2H5NH2, C6H5NH2.
b. Sai vì C6H5NH2 là arylamine.
c. Đúng.
d. Đúng.
Câu 13. Cho methylamine lần lượt tác dụng với dung dịch HCl, dung dịch FeCl3, dung dịch NaOH, dung dịch Br2, HNO2. Có bao nhiêu trường hợp xảy ra phản ứng?
Hướng dẫn giải
Đáp số 3.
Bao gồm: dung dịch HCl, dung dịch FeCl3, HNO2.
PTHH:
CH3NH2 + HCl → CH3NH3Cl.
3CH3NH2 + FeCl3 + 3H2O → Fe(OH)3 + 3CH3NH3Cl.
CH3NH2 + HNO2 → CH3OH + N2↑+ H2O.
Câu 14. Khối lượng methylamine (g) cần để tác dụng vừa đủ với 0,01 mol HCl là
Hướng dẫn giải
Đáp số 0,31.
PTHH: CH3NH2 + HCl → CH3NH3Cl
Lời giải:
Câu 15. Số đồng phân amine bậc ba có công thức C5H13N là bao nhiêu?
Hướng dẫn giải
Đáp số 3.
Có 3 đồng phân amine bậc ba có công thức C5H13N cụ thể là:
(CH3)2N – CH2 – CH2 – CH3, (CH3)2N – CH(CH3)2, (C2H5)2N – CH3.
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 6: Tinh bột và cellulose
Lý thuyết Bài 8: Amine
Lý thuyết Bài 9: Amino acid và peptide
Lý thuyết Bài 10: Protein và enzyme
Lý thuyết Bài 12: Đại cương về polymer
Lý thuyết Bài 13: Vật liệu polymer