Lý thuyết Hóa học 12 Bài 14: Tính chất hoá học của kim loại
A. Lý thuyết Tính chất hoá học của kim loại
I. Tác dụng với phi kim
Nhiều kim loại tác dụng được với các phi kim như oxygen, lưu huỳnh, halogen,…
Ví dụ:
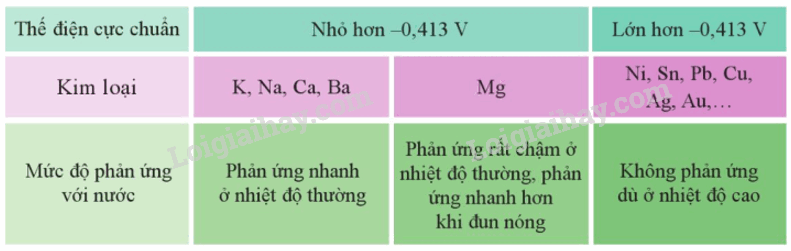
II. Tác dụng với nước
Trong môi trường trung tính, có:
2H2O + 2e H2 + OH– với E2H2O/2OH-+H2 = -0,413V
Cặp oxi hóa – khử Mn+/M có giá trị thế điện cực chuẩn nhỏ hơn – 0,413V thì kim loại M có thể tác dụng với nước ở nhiệt độ thường tạo thành hydroxide và khí hydrogen

III. Tác dụng với dung dịch muối
Kim loại không tan trong nước và có giá trị thế điện cực chuẩn nhỏ hơn thường tác dụng được với dung dịch muối của kim loại có giá trị thế điện cực lớn hơn ở điều kiện chuẩn.
Ví dụ: Zn(s) + CuSO4(aq) ZnSO4(aq) + Cu(s)
IV. Tác dụng với dung dịch acid
1. Tác dụng với dung dịch hydrochloric acid, dung dịch sulfuric acid loãng
Do nên kim loại M có giá trị thế điện cực chuẩn có theẻ khử được ion H+ trong dung dịch hydrchloric acid hoặc dung dihcj sulfuric acid loãng, tạo thành khí H2
Ví dụ: Zn(s) + 2H+(aq) Zn2+ (aq) + H2(g)
Do giá trị thế điện cực chuẩn dương nên các kim loại như Cu, Ag,… không tác dụng với dung dịch hydrochloric acid hoặc dung dịch sulfuric acid loãng.
2. Tác dụng với dung dịch sulfuric acid đặc
Hầu hết các kim loại (trừ Au và Pt) phản ứng được với dung dịch sulfuric acid đặc. Phản ứng này thường tạo thành muối sulfate, nước và sulfur dioxide. Phản ứng diễn ra mạnh hơn khi hỗn hợp phản ứng được đun nóng
Ví dụ: 
Sơ đồ tư duy Tính chất hóa học của kim loại

B. Trắc nghiệm Tính chất hoá học của kim loại
Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Mỗi câu hỏi chỉ chọn một phương án trả lời.
Câu 1: Cho bột Fe vào dung dịch AgNO3 và Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X gồm hai muối và chất rắn Y gồm hai kim loại. Hai muối trong X và hai kim loại trong Y lần lượt là
A. Cu(NO3)2; Fe(NO3)2 và Cu; Fe.
B. Cu(NO3)2; Fe(NO3)2 và Ag, Cu.
C. Fe(NO3)2; Fe(NO3)3 và Cu, Ag.
D. Cu(NO3)2; AgNO3 và Cu, Ag.
Hướng dẫn giải
Đáp án đúng là: B
Thứ tự phản ứng:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Vậy 2 kim loại thu được sau phản ứng là: Ag, Cu.
Dung dịch X gồm hai muối là: Cu(NO3)2 dư; Fe(NO3)2.
Câu 2: Cho 0,02 mol Na vào 1 000 mL dung dịch chứa CuSO4 0,05 M và H2SO4 0,005M. Hiện tượng của thí nghiệm trên là
A. có bọt khí bay lên và có kết tủa màu xanh lam.
B. chỉ có khí bay lên.
C. chỉ có kết tủa xanh lam.
D. có khí bay lên và có kết tủa sau đó kết tủa tan.
Hướng dẫn giải
Đáp án đúng là: A
nNa = 0,02 mol;
2Na + 2H2O → 2NaOH + H2↑
0,02 0,02 0,01 mol
2NaOH + H2SO4 → Na2SO4 + 2H2O
0,01 ← 0,005 mol
2NaOH + CuSO4 → Cu(OH)2 ↓ + Na2SO4
0,01 0,05 0,005mol
Vậy hiện tượng của thí nghiệm là: có bọt khí bay lên và có kết tủa màu xanh lam.
Câu 3: Kẽm khử được cation kim loại trong dãy muối nào dưới đây?
A. Cu(NO3)2, Pb(NO3)2, Ni(NO3)2.
B. AlCl3, MgCl2, Pb(NO3)2.
C. AlCl3, Ni(NO3)2, Pb(NO3)2.
D. MgCl2, NaCl, Cu(NO3)2.
Hướng dẫn giải
Đáp án đúng là: A
Dựa vào dãy điện hóa xác định được kẽm khử được cation kim loại trong dãy muối: Cu(NO3)2, Pb(NO3)2, Ni(NO3)2.
Câu 4: Cho 0,35 mol hỗn hợp X gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68
B. 24,32
C. 51,35
D. 48,65
Hướng dẫn giải
Đáp án đúng là: B
![]()
