Giải bài tập Hóa học 12 Bài 4: Tính chất hoá học của carbohydrate
Mở đầu trang 27 Hóa 12: Để chế tạo gương soi, ruột phích (ruột thủy tinh), người ta phủ lên thủy tinh một lớp bạc mỏng. Lớp bạc mỏng này thường được tạo thành từ phản ứng tráng bạc của glucose.
a) Glucose tham gia phản ứng tráng bạc do có nhóm chức nào trong phân tử
b) Ngoài glucose, các hợp chất carbohydrate khác như fructose, saccharose có phản ứng tráng bạc không? Vì sao?
Lời giải:
a) Glucose tham gia phản ứng tráng bạc do có nhóm – CHO trong phân tử
b) Ngoài glucose, các hợp chất fructose có phản ứng tráng bạc. Vì trong môi trường base fructose chuyển hóa thành glucose.
Thí nghiệm 1 trang 28 Hóa 12: Chuẩn bị:
– Hóa chất: Dung dịch glucose 2
– Dụng cụ: Ống nghiệm, đèn cồn, kẹp ống nghiệm
Tiến hành:
– Chuẩn bị hai ống nghiệm có đánh số (1) và (2); thêm vào mỗi ống nghiệm khoảng 0,5 – 1 ml dung dịch CuSO4 5
– Cho 3ml dung dịch glucose 2
– Đun nhẹ ống (2) đến khi hóa chất trong ống nghiệm đổi màu hoàn toàn
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích
Lời giải:
Hiện tượng:
– ống nghiệm (1) xuất hiện kết tủa trắng
– ống nghiệm (2) sau khi đun nóng nhẹ, kết tủa trắng tan dần tạo dung dịch màu xanh lam
Giải thích: dưới tác dụng của nhiệt độ, glucose phản ứng với Cu(OH)2
Câu hỏi 1 trang 28 Hóa 12: a) Trong phản ứng của glucose với Cu(OH)2, loại nhóm chứa nào của glucose đã tham gia phản ứng tạo dung dịch màu xanh lam?
b) Trong phản ứng của glucose với Cu(OH)2/ NaOH khi đun nóng, nhóm chức nào của glucose đã tham gia phản ứng tạo kết tủa đỏ gạch Cu2O?
Lời giải:
a) trong phản ứng của glucose với Cu(OH)2, nhóm –OH của glucose đã tham gia phản ứng tạo dung dịch màu xanh lam
b) Nhóm chức – CHO đã tham gia phản ứng tạo kết tủa đỏ gạch Cu2O
Thí nghiệm 2 trang 29 Hóa 12: Chuẩn bị
– Hóa chất: Dung dịch glucose 2
– Dụng cụ: Ống nghiệm, cốc nước nóng khoảng (70 – 80oC), ống hút nhỏ giọt.
Tiến hành:
– Cho vào ống nghiệm 1ml dung dịch AgNO3 1
– Tiếp tục thêm vào ống nghiệm 1ml dung dịch glucose 2
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích
Lời giải:
Hiện tượng: có một lớp bạc mỏng, sáng dưới đáy ống nghiệm
Giải thích: vì glucose có nhóm –CHO phản ứng với dung dịch AgNO3/ NH3
Luyện tập 1 trang 29 Hóa 12: Phản ứng tráng bạc thể hiện tính chất của nhóm chức nào trong phân tử glucose? Vì sao fructose cũng có tính chất này?
Lời giải:
Phản ứng tráng bạc thể hiện tính chất của nhóm – CHO trong phân tử glucose. Trong môi trường kiềm (dung dịch NH3) nhóm – CO của phân tử fructose chuyển hóa thành – CHO của phân tử glucose nên cũng có phản ứng tráng bạc.
Thí nghiệm 3 trang 29 Hóa 12: Cho vào ống nghiệm 1ml dung dịch glucose 5
Yêu cầu: Mô tả hiện tượng quan sát được
Lời giải:
Hiện tượng: nước bromine bị mất màu
Câu hỏi 2 trang 29 Hóa 12: Phản ứng của glucose với nước bromine thể hiện tính chất của nhóm chức nào trong phân tử chất này?
Lời giải:
Vì nhóm chức – CHO trong phân tử glucose phản ứng với dung dịch nước bromine
Câu hỏi 3 trang 30 Hóa 12: Nhóm – OH hemiacetal có đặc điểm gì khác so với các nhóm – OH khác trong phân tử glucose? Phân tử glucose ở dạng mạch hở có nhóm – OH hemiacetal nào không?
Lời giải:
Nhóm – OH hemiacetal được gắn vào vị trí số 1 và có khả năng mở vòng phân tử glucose. Phân tử glucose dạng hở không có nhóm –OH hemiacetal.
Thí nghiệm 4 trang 30 Hóa 12: Chuẩn bị:
– Hóa chất: Dung dịch saccharose 3
– Dụng cụ: Ống nghiệm, đèn cồn, ống hút nhỏ giọt
Tiến hành:
– Cho vào ống nghiệm khoảng 0,5 ml dung dịch NaOH 10
– Thêm tiếp vào ống nghiệm khoảng 4ml dung dịch saccharose 3
Yêu cầu: Quan sát, mô tả hiện tượng xảy ra và giải thích
Lời giải:
Hiện tượng: kết tủa trắng tan dần tạo dung dịch màu xanh lam
Giải thích: vì trong phân tử glucose có nhiều nhóm – OH có khả năng tạo phức xanh lam với kết tủa Cu(OH)2
Luyện tập 2 trang 31 Hóa 12: Giải thích vì sao khi đun nóng, saccharose không tạo kết tủa đỏ gạch với copper (II) hydroxide trong môi trường kiềm, nhưng sau khi đun nóng saccharose với dung dịch HCl loãng một thời gian, thì sản phẩm thu được lại tạo được kết tủa đỏ gạch với copper (II) hydroxide khi đun nóng.
Lời giải:
Khi đun nóng, saccharose không tạo kết tủa đỏ gạch với copper (II) hydroxide trong môi trường kiềm vì trong phân tử saccharose không có nhóm chứa – CHO.
Khi đun nóng saccharose với dung dịch HCl loãng, có phản ứng thủy phân saccharose tạo thành glucose và fructose mà glucose có phản ứng tạo màu đỏ gạch với copper(II) hydroxide.
Thí nghiệm 5 trang 31 Hóa 12: Chuẩn bị
– Hóa chất: Dung dịch hồ tinh bột, dung dịch I2 trong KI
– Dụng cụ: Ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm 1 ml dung dịch hồ tinh bột, thêm vài giọt dung dịch iodine trong KI. Lắc đều ống nghiệm
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích
Lời giải:
Hiện tượng: xuất hiện màu xanh tím
Giải thích: phân tử tinh bột hấp phụ iodine tạo thành hợp chất có màu xanh tím.
Thí nghiệm 6 trang 32 Hóa 12: Cho vào ống nghiệm (1) khoảng 3ml dung dịch hồ tinh bột 2
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích
Lời giải:
Khi cho dung dịch hồ tinh bột và 1 ml H2SO4 đặt trong nồi nước sôi, khi nhỏ 1-2 giọt dung dịch I2 trong KI, ống nghiệm (1) có màu vàng (màu của dung dịch I2 trong KI) vì tinh bột bị thủy phân trong môi trường acid tạo ra maltose và glucose không có phản ứng với I2 trong KI
Nếu dung dịch có màu xanh tím tức là ống nghiệm (1) phản ứng thủy phân tinh bột chưa xảy ra hoàn toàn.
Khi nhỏ dung dịch đã thủy phân sang ống nghiệm 2, cho từng giọt dung dịch NaOH và dung dịch CuSO4 sẽ tạo kết tủa trắng Cu(OH)2. Lắc đều và đun nóng ống nghiệm kết tủa trắng tan dần tạo dung dịch xanh lam, nếu tiếp tục đun nóng nhẹ sẽ xuất hiện kết tủa màu đỏ gạch. Vì khi thủy phân tinh bột tạo ra glucose có phản ứng tạo phức copper (II) hydroxide.
Luyện tập 3 trang 32 Hóa 12: Trong công nghệ sản xuất bia có các bước chính sau:
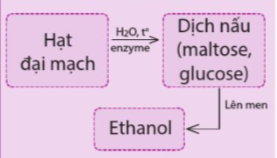
a) Thành phần nào trong hạt đại mạch bị thủy phân tạo ra maltose, glucose?
b) Đề xuất cách kiểm tra để biết được thời điểm kết thúc quá trình thủy phân tinh bột.
Lời giải:
a) Thành phần tinh bột trong hạt đại mạch bị thủy phân tạo ra maltose, glucose.
b) Để xác định thời điểm quá trình thủy phân tinh bột có thể sử dụng dung dịch I2 trong KI vì sản phẩm thủy phân của tinh bột không có phản ứng tạo màu xanh tím với dung dịch I2 trong KI.
Thí nghiệm 7 trang 32 Hóa 12: Cho vào ống nghiệm (1) một nhúm nhỏ bông và khoảng 2 ml dung dịch H2SO4 70
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích.
Lời giải:
Ống nghiệm (2) xuất hiện kết tủa trắng Cu(OH)2, sau khi lắc đều và đun nóng nhẹ, kết tủa trắng tan dần tạo dung dịch xanh lam, nếu tiếp tục đun nóng nhẹ màu xanh lam chuyển thành kết tủa đỏ gạch.
Câu hỏi 5 trang 32 Hóa 12: Chất nào trong dung dịch ở Thí nghiệm 7 có phản ứng trong môi trường kiềm tạo kết tủa đỏ gạch?
Lời giải:
Nhóm chức – CHO trong phân tử glucose có phản ứng trong môi trường kiềm tạo kết tủa đỏ gạch.
Vận dụng trang 33 Hóa 12: Vì sao một số động vật có thể sử dụng cỏ làm thức ăn trong khi nhiều đồng vật khác không có khả năng này?
Lời giải:
Một số động vật có enzyme cellulase tạo môi trường để thủy phân cellulose trong cây cỏ.
Thí nghiệm 8 trang 33 Hóa 12: Cho 5ml dung dịch HNO3 65
Yêu cầu: Quan sát, mô tả hiện tượng và giải thích.
Lời giải:
Miếng bông có tẩm hóa chất khi đốt không có khói, có tiếng nổ nhỏ vì cellulose trong miếng bông đã có phản ứng với acid HNO3 trong môi trường H2SO4 đặc nóng tạo ra cellulose trinitrate
Miếng bông không có hóa chất cháy có khói, mùi khét.
Thí nghiệm 9 trang 33 Hóa 12: Hòa tan hoàn toàn 2,5g CuSO4.5H2O vào 100ml nước trong cốc thủy tinh. Thêm tiếp vào cốc 10ml dung dịch NaOH 10
Yêu cầu: Quan sát và mô tả hiện tượng thí nghiệm
Lời giải:
Phản ứng dung dịch NaOH với CuSO4 tạo ra kết tủa trắng Cu(OH)2, khi cho thêm dung dịch NH3 tạo ra phức chất xanh lam của ion Cu2+ với ammonia. Sau khi cho nhúm bông vào cốc có chứa phức chất, nhúm bông tan dần tạo thành dung dịch đồng nhất.
Bài tập
Bài 1 trang 34 Hóa 12: Nhận xét nào dưới đây là không đúng khi nói về glucose và fructose?
A. Đều tạo được dung dịch màu xnah lam khi tác dụng với Cu(OH)2 trong môi trường kiềm
B. Đều tạo được kết tủa đỏ gạch Cu2O khi tác dụng với Cu(OH)2 đun nóng trong môi trường kiềm
C. Đều làm mất màu nước bromine
D. Đều xảy ra phản ứng tráng bạc khi tác dụng với thuốc thử Tollens.
Lời giải:
Trong phân tử glucose có nhóm chức – CHO có phản ứng làm mất màu nước bromine, phân tử fructose có chứa nhóm chức – CO không làm mất màu nước bromine.
Bài 2 trang 34 Hóa 12: Vì sao không thể phân biệt glucose và fructose qua phản ứng giữa chúng với thuốc thử Tollens nhưng có thể phân biệt qua phản ứng với nước bromine?
Lời giải:
Thuốc thử Tollens (dung dịch AgNO3/NH3) có môi trường kiềm, trong môi trường kiềm glucose và fructose chuyển hóa lẫn nhau nên không thể phân biệt 2 dung dịch.
Trong phân tử glucose có nhóm chức – CHO có phản ứng làm mất màu nước bromine, phân tử fructose có chứa nhóm chức – CO không làm mất màu nước bromine nên có thể dung phản ứng với dung dịch bromine để phân biệt 2 dung dịch.
Bài 3 trang 34 Hóa 12: Ethanol có thể được sản xuất từ cellulose hoặc tinh bột. Loại ethanol này được dùng để sản xuất xăng E5 (xăng chứa 5
Lời giải:
Khối lượng cellulose là: 1. 50
n cellulose = k.mol
Vì hiệu suất của quá trình là 60
Thể tích ethanol thu được từ 1 tấn mùn cưa là: V = m : D =
Thể tích xăng E5 được pha chế là: 213 : 5
Bài 4 trang 34 Hóa 12: Thêm vài giọt nước bromine vào ống nghiệm chứa dung dịch potassium iodide và hồ tinh bột, lắc đều. Dự đoán và giải thích hiện tượng xảy ra.
Lời giải:
Khi cho nước bromine (Br2) màu vàng nâu vào dung dịch potassium iodide (KI) không màu có thêm hồ tinh bột thì thấy dung dịch màu vàng nâu chuyển sang màu xanh tím.
Giải thích: Br2 (màu vàng nâu) đã phản ứng với dung dịch KI (không màu) để hình thành đơn chất I2. Sau đó tinh bột hấp thụ I2 tạo hợp chất có màu xanh tím đặc trưng.
Lý thuyết Tính chất hoá học của carbohydrate
I. Tính chất hóa học của glucose và fructose
1. Phản ứng với copper(II) hydroxide
– Glucose và fructose tác dụng với copper(II) hydroxide trong môi trường kiềm ở điều kiện thường tạo thành phức chất màu xanh lam, tan trong nước.
– Đun nóng dung dịch chứa glucose và Cu(OH)2 trong môi trường kiềm sẽ xuất hiện kết tủa đỏ gạch do Cu(OH)2 bị khử thành Cu2O.
– Fructose cũng tham gia phản ứng trên và tạo thành kết tủa đỏ gạch Cu2O tương tự như glucose do trong môi trường kiềm, fructose có thể chuyển hóa thành hợp chất có chứa nhóm chức aldehyde.
2. Phản ứng với thuốc thử Tollens
Glucose và fructose đều tham gia phản ứng với thuốc thử Tollens để tạo thành kết tủa bạc kim loại (phản ứng tráng bạc)

3. Phản ứng với nước bromine
– Phản ứng của glucose với nước bromine làm nước bromine bị mất màu và tạo thành gluconic acid theo phương trình hóa học sau:

– Fructose không làm mất màu nước bromine
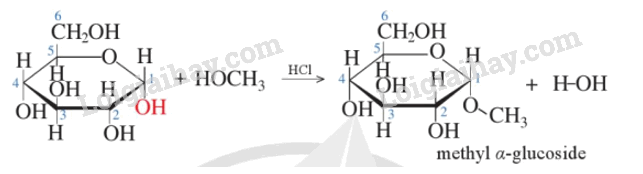
4. Phản ứng với alcohol
Khi dẫn khí hydrogen chloride vào dung dịch của glucose trong alcohol, nhóm – OH hemiacetal được thay thế bằng nhóm – OR của alcohol.
5. Phản ứng lên men
– Glucose và fructose bị lên men tạo thành các sản phẩm khác, tùy thuộc vào loại enzyme có trong men được sử dụng:
Lên men rượu: ![]()
Lên men lactic: ![]()
II. Tính chất hóa học của saccharose
1. Phản ứng với copper(II) hydroxide
Dung dịch màu xanh lam được tạo thành khi cho dung dịch saccharose tác dụng với copper(II) hydroxide trong môi trường kiềm
2C12H22O11 + Cu(OH)2 Cu(C12H21O11)2 + 2H2O
2. Phản ứng thủy phân
Saccharose bị thủy phân tạo thành glucose và fructose. Phản ứng xảy ra khi có xúc tác acid hoặc có mặt của enzyme

III. Tính chất hóa học của tinh bột
1. Phản ứng với iodine
Phân tử tinh bột hấp phụ iodine tạo thành hợp chất có màu xanh tím. Quá trình này được dùng để nhận ra tinh bột bằng iodine và ngược lại.
2. Phản ứng thủy phân
Phản ứng thủy phân tinh bột xảy ra khi có xúc tác acid (hoặc enzyme) và diễn ra qua nhiều giai đoạn. Các giai đoạn trung gian tạo thành dextrin (C6H10O5)x ( x < n) và maltose. Sản phẩm cuối cùng của quá trình thủy phân là glucose.

IV. Tính chất hóa học của cellulose
1. Phản ứng thủy phân
Cellulose bị thủy phân khi đun nóng với dung dịch acid vô cơ hoặc có mặt enzyme cellulase (thường có trong dạ dày động vật ăn cỏ). Sản phẩm cuối cùng nhận được khi thủy phân cellulose là glucose.
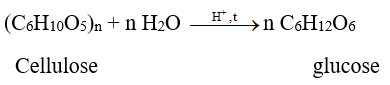
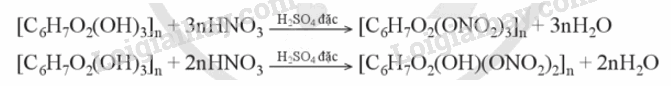
2. Phản ứng với nitric acid
Các nhóm hydroxy trong các đơn vị glucose trong phân tử cellulose trong phản ứng với dung dịch nitric acid đặc khi có mặt dung dịch sulfuric acid đặc, tạo ra các sản phẩm như cellulose trinitrate, cellulose dinitrate tùy thuộc vào điều kiện phản ứng
3. Tác dụng với nước Schweizer
Cellulose không tan trong nước nhưng tan trong nước Schweizer (dung dịch chứa phức chất của ion Cu2+ với ammonia).
Sơ đồ tư duy Tính chất hóa học của carbohydrate
Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 3. Giới thiệu về carbohydrate
Bài 4. Tính chất hoá học của carbohydrate
Bài 5. Amine
Bài 6. Amino acid
Bài 7. Peptide, protein và enzyme
Bài 8. Đại cương về polymer