Câu hỏi:
Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO320%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2bay ra (đktc) và được dung dịch T. Thêm một lượng O2vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3trong T gần nhất với
A.9,5%
B.9,6%
C.9,4%
D.9,7%
Đáp án chính xác
Trả lời:
Khi thêm O2vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2bị hấp thụ khí còn lại là N2O và N2.
=>nNO= nNO2= 0,3 – 0,2 = 0,1 mol
Áp dụng đường chéo cho hỗn hợp Z:
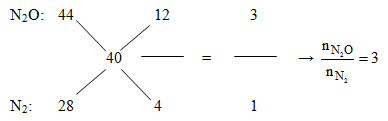
Mà nN2O+ nN2= nZ= 0,2 mol =>nN2O= 0,15 và nN2= 0,05
Đặt: nMg= 4x và nAl = 5x (mol) =>nMg(OH)2= 4x và mAl(OH)3= 5x
m kết tủa max = mKL+ mOH-=>m + 39,1 = m + 17(4x.2 + 5x.3) =>x = 0,1
=>nMg= 0,4 mol và nAl = 0,5 mol
Ta thấy: 2nMg + 3nAl >3nNO+ 8nN2O+ 10nN2=>Có tạo muối NH4NO3
Bảo toàn e: 2nMg + 3nAl = 3nNO + 8nN2O+ 10nN2+ 8nNH4NO3
=>2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3
=>nNH4NO3= 0,0375 mol
Công thức tính nhanh: nHNO3 pư= 4nNO+ 10nN2O + 12nN2 + 10nNH4NO3= 2,875 mol
=>nHNO3 bđ= 2,875 + 2,875.(20/100) = 3,45 mol
=>m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam
m dd sau pư = mMg+ mAl + m dd HNO3 – mNO– mN2O– mN2
= 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28 = 1098,85 gam
Ta có: nAl(NO3)3= nAl= 0,5 mol
→ %mAl= (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7%
Đáp án cần chọn là: D
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho 19,2 gam kim loại M tan trong dung dịch HNO3dư được 4,48 lít NO (đktc, là sản phẩm khử duy nhất). M là – ĐGNL-HN
Câu hỏi:
Cho 19,2 gam kim loại M tan trong dung dịch HNO3dư được 4,48 lít NO (đktc, là sản phẩm khử duy nhất). M là
A.Fe
B.Cu
Đáp án chính xác
C.Zn
D.Mg
Trả lời:
nNO= 0,2 molQuá trình cho – nhận e:\(\mathop M\limits^0 \, \to \mathop M\limits^{ + n} \,\, + \,ne{\rm{\;\;\;\;\;\;}}\,\,\,\,\,\,\,\,{\rm{\;\;\;}}\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)\(\frac{{0,6}}{n}\;\;{\rm{ }}\; \leftarrow \;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;0,6\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}\;{\rm{ }}0,6\;{\rm{ }}\; \leftarrow \;{\rm{ }}\;0,2\)\( = >\,\,\frac{{19,2}}{M} = \frac{{0,6}}{n}\,\, = >\,\,M = 32n\)Với n = 2 =>M = 64 =>M là CuĐáp án cần chọn là: B
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Hoà tan hết 5,4 gam kim loại M trong HNO3dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2và N+4là sản phẩm khử của N+5 – ĐGNL-HN
Câu hỏi:
Hoà tan hết 5,4 gam kim loại M trong HNO3dư được 8,96 lít khí đktc gồm NO và NO2, dX/H2 = 21. Tìm M biết rằng N+2và N+4là sản phẩm khử của N+5
A.Fe
B.Al
Đáp án chính xác
C.Zn
D.Mg
Trả lời:
Gọi nNO= x mol; nNO2= y mol
=>nhỗn hợp khí= x + y = 0,4 mol (1)
\(\bar M = \frac{{30x + 46y}}{{x + y}} = 21.2\)(2)
Từ (1) và (2) =>x = 0,1; y = 0,3
Quá trình cho – nhận e:
\(\begin{array}{*{20}{c}}{}&{\mathop M\limits^0 \, \to \mathop M\limits^{ + n} \,\, + \,ne;\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O}\\{}&{\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 5} \,\,\, + {\rm{\;1}}e \to \mathop {\,N}\limits^{ + 4} \,{O_2}}\end{array}\)
Bảo toàn e: ne cho = ne nhận= 3.nNO+ nNO2= 0,6
\( = >\,\,\frac{{5,4}}{M}.n = 0,6\,\, = >\,\,M = 9n\)
Với n = 3 =>M = 27 =>M là Al
Đáp án cần chọn là: B====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho 11 gam hỗn hợp gồm Al và Fe vào dung dịch HNO3dư được 6,72 lít NO (đktc, là sản phẩm khử duy nhất). Khối lượng của Al và Fe lần lượt là – ĐGNL-HN
Câu hỏi:
Cho 11 gam hỗn hợp gồm Al và Fe vào dung dịch HNO3dư được 6,72 lít NO (đktc, là sản phẩm khử duy nhất). Khối lượng của Al và Fe lần lượt là
A.5,6 gam và 5,4 gam
B.5,4 gam và 5,6 gam
Đáp án chính xác
C.4,4 gam và 6,6 gam
D.4,6 gam và 6,4 gam
Trả lời:
Gọi số mol của Al và Fe lần lượt là x và y mol=>mhỗn hợp= 27x + 56y = 11 (1)Quá trình cho – nhận e:\(Al \to \mathop {Al}\limits^{ + 3} \,\,\,\, + \,\,\,3e{\rm{\;\;\;\;\;\;}}\,\,\,\,\,\,\,\,{\rm{\;\;}}\)\(\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)\(Fe\, \to \mathop {\,Fe}\limits^{ + 3} \,\,\, + \,\,\,3e\)Bảo toàn e: 3.nAl + 3.nFe= 3.nNO=>x + y = 0,3 (2)Từ (1) và (2) =>x = 0,2; y = 0,1=>mAl= 0,2.27 = 5,4 gam; mFe= 0,1.56 = 5,6 gamĐáp án cần chọn là: B
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Hoà tan hết m gam Al vào dung dịch HNO3dư được 0,01 mol NO và 0,015 mol N2O là các sản phẩm khử của N+5. Giá trị của m là – ĐGNL-HN
Câu hỏi:
Hoà tan hết m gam Al vào dung dịch HNO3dư được 0,01 mol NO và 0,015 mol N2O là các sản phẩm khử của N+5. Giá trị của m là
A.5,4 gam
B.2,7 gam
C.1,35 gam
Đáp án chính xác
D.8,1 gam
Trả lời:
Xét quá trình cho – nhận e:\(Al \to \mathop {Al}\limits^{ + 3} \,\, + \,3e{\rm{\;}}\)\({\rm{\;}}\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)\(\,\,\mathop {2N}\limits^{ + 5} \,\,\, + {\rm{\;8}}e \to \mathop {\,{N_2}}\limits^{ + 1} \,O\)Bảo toàn e: 3.nAl= 3.nNO+ 8.nN2O=>nAl = (3.0,01 + 8.0,015) / 3 = 0,05 mol=>m = 0,05.27 = 1,35 gamĐáp án cần chọn là: C
====== **** mời các bạn xem câu tiếp bên dưới **** =====
- Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3đã dùng là – ĐGNL-HN
Câu hỏi:
Cho 6,4 gam Cu tan vừa đủ trong 200ml dung dịch HNO3thu được khí X gồm NO và NO2, dX/H2 = 18 (không còn sản phẩm khử nào khác của N+5). Nồng độ mol/lít của dung dịch HNO3đã dùng là
A.2M
B.1,2M
C.1,4M
D.13/9M
Đáp án chính xác
Trả lời:
nCu= 0,1 mol
Gọi số mol của NO và NO2lần lượt là x và y mol
Xét quá trình cho – nhận e:
\(Cu \to \mathop {Cu}\limits^{ + 2} \,\, + \,2e\)
\(\mathop N\limits^{ + 5} \,\,\, + {\rm{\;3}}e \to \mathop {\,N}\limits^{ + 2} \,O\)
\(\mathop N\limits^{ + 5} \,\,\, + {\rm{\;1}}e \to \mathop {\,N}\limits^{ + 4} \,{O_2}\)
Bảo toàn e: 2.nCu= 3.nNO+ nNO2=>3x + y = 0,2 (1)
\({\bar M_X} = \frac{{30x + 46y}}{{x + y}} = 18.2\,\,\,\,(2)\)
Từ (1) và (2) =>x = 1/18 mol; y = 1/30 mol
Bảo toàn nguyên tố N: nHNO3 phản ứng = nNO3 (trong muối)+ nNO+ nNO2= 0,1.2 + 1/18 + 1/30 = 13/45 mol
=>CM HNO3= 13/9 M
Đáp án cần chọn là: D====== **** mời các bạn xem câu tiếp bên dưới **** =====
