Lý thuyết Hóa học 12 Bài 28: Sơ lược về phức chất
A. Lý thuyết Sơ lược về phức chất
I. Một số khái niệm cơ bản về phức chất
– Phức chất là hợp chất có chứa nguyên tử trung tâm (thường được kí hiệu là M) và các phối tử (thường được kí hiệu là L). Trong đó, nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại liên kết với các phối tử.
– Phối tử là anion hoặc phân tử. Phức chất có thể mang điện tích hoặc không mang điện tích.
– Trong công thức phức chất, nguyên tử trung tâm M và các phối tử L thường được đặt trong móc vuông.
Ví dụ: Phức chất [Co(NH3)6]3+ có điện tích là +3, nguyên tử trung tâm là Co3+ và phối tử là NH3.
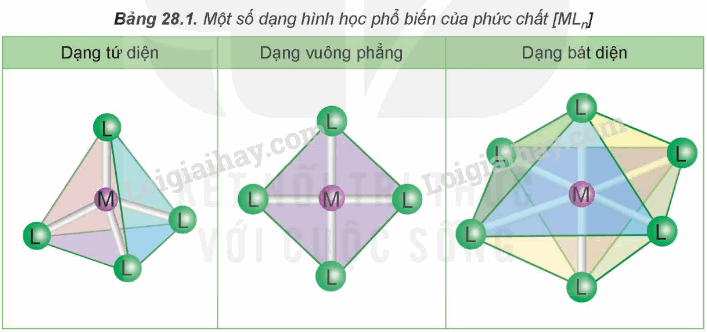
II. Một số dạng hình học của phức chất
Trong phức chất [MLn] (điện tích đã được lược bỏ), các phối tử L sắp xếp một các xác định xung quanh nguyên tử trung tâm M tạo ra các dạng hình học khác nhau, phổ biến là dạng tứ diện, vuông phẳng và bát diện.
III. Liên kết trong phức chất
1. Liên kết giữa nguyên tử trung tâm và phối tử
– Liên kết hóa học giữa nguyên tử trung tâm M và phối tử L trong phức chất là liên kết cho – nhận, được hình thành nhờ sự cho cặp electron chưa liên kết của phối tử vào orbital trống của nguyên tử trung tâm.
2. Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp.
– Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hóa trị kiểu cho – nhận, hình thành phức chất aqua.
Sơ đồ tư duy Sơ lược về phức chất

B. Trắc nghiệm Sơ lược về phức chất
Câu 1. Cho biết số lượng phối tử có trong phức chất [Cu(H2O)6]2+ là
A. 2
B. 6
C. 4
D.5.
Hướng dẫn giải
Đáp án đúng là: B
Phức chất [Cu(H2O)6]2+ chứa 6 phối tử H2O.
Câu 2. Phát biểu nào dưới đây là sai?
A. Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại có orbital trống đã nhận cặp electron chưa liên kết của phối tử.
B. Phối tử cho cặp electron chưa liên kết vào orbital trống của nguyên tử trung tâm.
C. Phức lập phương chỉ biết đối với các ion có kích thước rất lớn so với kích thước phối tử.
D. Phức chất luôn mang điện tích dương hoặc âm.
Hướng dẫn giải
Đáp án đúng là: D
Vì phức chất có thể mang điện tích hoặc không mang điện tích.
Câu 3. Phân tử ethylamine (C2H5NH2) có số cặp electron chưa liên kết là
A. 1
B. 2
C. 3
D. 4.
Hướng dẫn giải
Đáp án đúng là: A
Dựa vào công thức Lewis ta thấy: nguyên tử N trong C2H5NH2 đã tạo liên kết đơn với 2 nguyên tử H và 1 nguyên tử C, vậy nên còn 1 cặp electron chưa liên kết.
Câu 4. Nguyên tử trung tâm của phức [Co(NH3)6]3+ là ?
A. N
B. Co
C. Co3+
D. NH3
Hướng dẫn giải
Đáp án đúng là: C
Nguyên tử trung tâm của phức [Co(NH3)6]3+ là Co3+ (do ammonia không mang điện tích, điện tích 3+ phải thuộc về nguyên tử trung tâm).
Câu 5. Công thức tổng quát của phức chất (với nguyên tử trung tâm M và phối tử L) có dạng tứ diện và bát diện lần lượt là
A. [ML2] và [ML4].
B. [ML4] và [ML6].
C. [ML6] và [ML2].
D. [ML6] và [ML4].
Hướng dẫn giải
Đáp án đúng là: B
Phức chất (với nguyên tử trung tâm M và phối tử L) có công thức tổng quát [ML6] có dạng hình học bát diện, công thức tổng quát [ML4] có dạng hình học là tứ diện và vuông phẳng.
Câu 6. Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có
A. các orbital trống.
B. cặp electron hoá trị riêng.
C. ít nhất 4 orbital trống.
D. ít nhất hai cặp electron hoá trị riêng.
Hướng dẫn giải
Đáp án đúng là: B
Theo thuyết Liên kết hoá trị, để trở thành phối tử trong phức chất thì phân tử hoặc anion cần có cặp electron hoá trị riêng.
Câu 7. Cho phát biểu sau: “Phức chất đơn giản thường có một …(1)… liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết …(2)….”. Cụm từ cần điền vào (1) và (2) lần lượt là
A. cation kim loại, ion.
B. nguyên tử kim loại, cho − nhận.
C. nguyên tử trung tâm, cho − nhận.
D. phối tử, ion.
Hướng dẫn giải
Đáp án đúng là: D
Phức chất đơn giản thường có một nguyên tử trung tâm, liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho − nhận.
Câu 8. Cho phát biểu đúng nhất về dạng hình học có thể có của phức chất có dạng tổng quát [ML4]
A. Tứ diện.
B. Bát diện.
C. Vuông phẳng.
D. Tứ diện hoặc vuông phẳng.
Hướng dẫn giải
Đáp án đúng là: D
Dạng hình học có thể có của phức chất có dạng tổng quát [ML4] là tứ diện hoặc vuông phẳng.
Câu 9. Số lượng phối tử có trong mỗi phức chất [PtCl4]2− và [Fe(CO)5] là
A. 4 và 5.
B. 5 và 6.
C. 5 và 2.
D. 1 và 2.
Hướng dẫn giải
Đáp án đúng là: A
Trong phức chất [PtCl4]2− có 4 phối tử Cl− và trong phức chất [Fe(CO)5] có 5 phối tử CO.
Câu 10. Dạng hình học có thể có của phức chất [FeF6]3− là
A. Tứ diện.
B. Bát diện.
C. Vuông phẳng.
D. Tứ diện hoặc vuông phẳng.
Hướng dẫn giải
Đáp án đúng là: B
Phức chất [FeF6]3− có dạng [ML6] nên dạng hình học là bát diện.
Câu 11. Một phức chất có công thức [Fe(H2O)6](NO3)3
a. Nguyên tử trung tâm là cation Fe2+.
b. Phối tử là
c. Trong phức chất trên nguyên tử Fe chiếm 16% về khối lượng.
d. Tỉ lệ khối lượng của phối tử và nguyên tử trung tâm là 14 : 27.
Hướng dẫn giải
a. Sai nguyên tử trung tâm là cation Fe3+
b. Sai vì phối tử là H2O.
c. Đúng vì
d. Sai vì
Câu 12. Khi cho copper(II) hydroxide vào dung dịch NH3 dư thì hình thành phức vuông phẳng với các phối tử là NH3.
a. Công thức của phức trên là [Cu(NH3)4](OH)2.
b. Trong phức trên NH3 là phối tử còn Cu2+ là nguyên tử trung tâm.
c. Khi hình thành liên kết các phân tử NH3 đã nhận cặp electron tự do của Cu2+.
d. [Cu(NH3)4](OH)2 là chất kết tủa màu xanh thẫm.
Hướng dẫn giải
a. Đúng.
b. Đúng.
c. Sai vì NH3 đã cho cặp electron tự do vào AO trống của Cu2+.
d. Sai vì [Cu(NH3)4](OH)2 là dung dịch màu xanh thẫm.
Câu 13. Cho phức chất [PtCl4]2−, nguyên tử trung tâm Pt tạo bao nhiêu liên kết s với phối tử Cl−?
Hướng dẫn giải
Đáp số: 4.
Giải thích:
Trong phức chất [PtCl4]2− nguyên tử trung tâm Pt tạo 4 liên kết s với phối tử Cl−
Câu 14. Nguyên tử trung tâm trong phức chất [Cu(H2O)]2+ mang bao nhiêu điện tích dương?
Hướng dẫn giải
Đáp số: 2.
Giải thích:
Do phức chất [Cu(H2O)]2+ mang điện tích là 2+ mà phối tử H2O không mang điện nên nguyên tử trung tâm là Cu2+
Câu 15. Cho phức chất [Cr(NH3)6]3+, hãy cho biết có bao nhiêu nhận định đúng trong các nhận định sau :
a. Phức chất trên có nguyên tử trung tâm là NH3.
b. Phức chất trên có điện tích là 3+.
c. Trong phức [Cr(NH3)6]3+, NH3 đóng vai trò là phối tử.
d. Liên kết giữa phối tử NH3 và nguyên tử trung tâm Cr là liên kết cho − nhận.
Hướng dẫn giải
Đáp số: 3.
Giải thích:
a. Sai vì nguyên tử trung tâm là Cr.
b. Đúng.
c. Đúng.
d. Đúng.
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 22: Sự ăn mòn kim loại
Lý thuyết Bài 24: Nguyên tố nhóm IA
Lý thuyết Bài 25: Nguyên tố nhóm IIA
Lý thuyết Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Lý thuyết Bài 28: Sơ lược về phức chất
Lý thuyết Bài 29: Một số tính chất và ứng dụng của phức chất