Lý thuyết Hóa học 12 Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
A. Lý thuyết Đại cương về kim loại chuyển tiếp dãy thứ nhất
I. Đơn chất kim loại chuyển tiếp dãy thứ nhất
1. Đặc điểm cấu tạo nguyên tử
– Các nguyên tố từ Sc (Z=21) đến Cu (Z = 29) được gọi là nguyên tố chuyển tiếp dãy thứ nhất.
– Đặc điểm cấu hình electron trong nguyên tử của các kim loại chuyển tiếp dãy thứ nhất đều có lớp vỏ bên trong của khí hiếm Ar.
– Số electron trên phân lớp 3d tăng dầu từ 1 đến 10. Trong khi đó trên phân lớp 4s, số electron thường bằng 2.
– Nguyên tử của các kim loại chuyển tiếp dãy thứ nhất có nhiều electron hóa trị thuộc phân lớp 3d và 4s nên kim loại chuyển tiếp dãy thứ nhất thường tạo thành các hợp chất với nhiều số oxi hóa khác nhau.
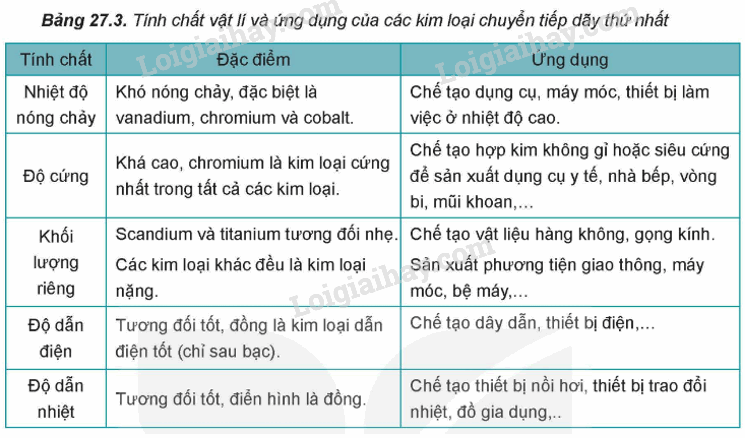
2. Tính chất vật lí và ứng dụng của kim loại chuyển tiếp.
II. Hợp chất của kim loại chuyển tiếp dãy thứ nhất
1. Số oxi hóa của nguyên tử kim loại chuyển tiếp dãy thứ nhất trong hợp chất.
– Do có nhiều electron hóa trị (ở phân lớp 4s và 3d) nên các nguyên tố chuyển tiếp dãy thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hóa khác nhau.
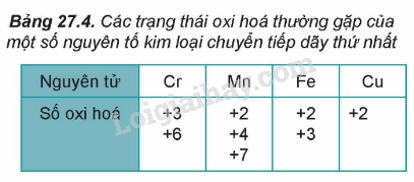
– Khi tham gia phản ứng hóa học, nguyên tử kim loại chuyển tiếp dãy thứ nhất ưu tiên nhường electron ở phân lớp 4s trước rồi đến electron ở phân lớp 3d, tạo thành các cation tương ứng.
2. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
Các ion kim loại chuyển tiếp dãy thứ nhất có màu sắc phong phú.
3. Chuẩn độ iron(II) sulfate bằng thuốc tím
– Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng phương pháp chuẩn độ với dung dịch thuốc tím trong môi trường sulfuric theo phương trình hóa học
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
4. Nhận biết một số ion kim loại chuyển tiếp
Trong hóa học, các ion kim loại chuyển tiếp thường được nhận biết dựa vào màu sắc đặc trưng của ion, của hợp chất ít tan hoặc của phức chất tương ứng.
Sơ đồ tư duy Đại cương về kim loại chuyển tiếp dãy thứ nhất

B. Trắc nghiệm Đại cương về kim loại chuyển tiếp dãy thứ nhất
Câu 1. Ion nào sau đây không có electron trên phân lớp 3d và không có màu trong dung dịch nước?
A. Fe3+.
B. Cr3+.
C. Ti3+.
D. Sc3+.
Hướng dẫn giải
Đáp án đúng là: D
Sc có cấu hình electron là: [Ar]3d14s2 ⟹ Sc3+ có cấu hình electron: [Ar]. Sc3+ không có electron trên phân lớp 3d và không có màu trong dung dịch nước.
Câu 2. Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở
A. phân lớp 3d và phân lớp 4s.
B. phân lớp 3d.
C. lớp 4s.
D. phân lớp 3p và phân lớp 3d.
Hướng dẫn giải
Đáp án đúng là: A
Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở phân lớp 3d và phân lớp 4s.
Câu 3. Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là
A. [Ne]3d1÷104s1÷2.
B. [Ar]3d1÷104s1÷2.
C. [Ar]3d1÷104s2.
D. [Ar]3d104s1÷2.
Hướng dẫn giải
Đáp án đúng là: B
Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là [Ar]3d1÷104s1÷2.
Câu 4. Để phân biệt dung dịch H2SO4 đặc nguội và dung dịch HNO3 đặc nguội, có thể dùng kim loại nào sau đây?
A. Cr.
B. Al.
C. Fe.
D. Cu.
Hướng dẫn giải
Đáp án đúng là: D
Cr, Al, Fe đều thụ động hóa trong H2SO4 đặc nguội và dung dịch HNO3 đặc nguội nên không thể dùng 3 kim loại này.
Cu tác dụng với H2SO4 đặc nguội cho khí SO2 không màu và tác dụng với dung dịch HNO3 đặc nguội cho khí NO2 màu nâu đỏ.
Câu 5. Muối nào sau đây vừa có khả năng thể hiện tính oxi hóa (trong môi trường acid), vừa có khả năng thể hiện tính khử (trong môi trường kiềm)?
A. K2Cr2O7.
B. Cr2(SO4)3.
C. K2CrO4.
D. Na2CrO4.
Hướng dẫn giải
Đáp án đúng là: B
Nguyên tử Cr trong muối Cr2(SO4)3 có số oxi hóa là +3, có khả năng thể hiện tính khử (lên +6) hoặc tính oxi hóa (về +2 hoặc 0).
Câu 6. Dung dịch nào sau đây có màu vàng chanh?
A. CuSO4.
B. FeCl3.
C. KMnO4.
D. FeSO4.
Hướng dẫn giải
Đáp án đúng là: B
Dung dịch FeCl3 có màu vàng chanh.
Câu 7. Cấu hình electron nào sau đây là của ion Fe2+?
A. [Ar]3d6.
B. [Ar]3d5.
C. [Ar]3d4.
D. [Ar]3d3.
Hướng dẫn giải
Đáp án đúng là: A
Cấu hình electron của Fe: [Ar]3d64s2 ⟹ cấu hình electron ion Fe2+: [Ar]3d6.
Câu 8. Nhỏ từ từ dung dịch H2SO4 loãng vào
dung dịch K2CrO4 thì màu của dung dịch chuyển từ
A. không màu sang màu vàng.
B. màu da cam sang màu vàng.
C. không màu sang màu da cam.
D. màu vàng sang màu da cam.
Hướng dẫn giải
Đáp án đúng là: D
Muối cromat có màu vàng, muối có màu da cam đều bền. Trong dung dịch có cân bằng: + 2H+ ⟺ + H2O. Vì vậy, khi nhỏ từ dung dịch H2SO4 loãng, dư vào dung dịch K2CrO4 thì cân bằng trên sẽ chuyển dịch về phía bên phải (phía làm giảm nồng độ H+) màu của dung dịch chuyển từ màu vàng sang màu da cam.
Câu 9. Mô tả phù hợp với thí nghiệm nhúng thanh Cu (dư) vào dung dịch FeCl3 là
A. bề mặt thanh kim loại đồng có màu trắng hơi xám.
B. dung dịch từ màu vàng nâu chuyển dần qua màu xanh.
C. dung dịch có màu vàng nâu.
D. khối lượng thanh đồng kim loại tăng lên.
Hướng dẫn giải
Đáp án đúng là: B
Khi nhúng thanh Cu (dư) vào dung dịch FeCl3 thì dung dịch từ màu vàng nâu (của FeCl3) chuyển dần qua màu xanh (của CuCl2, FeCl2).
Phương trình hóa học: Cu + 2FeCl3 ⟶ CuCl2 + 2FeCl2
Câu 10. Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử thay đổi như thế nào?
A. Tăng dần.
B. Không đổi.
C. Giảm dần.
D. Không có quy luật.
Hướng dẫn giải
Đáp án đúng là: C
Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử giảm dần từ Sc đến Cr.
Câu 11. Muối CuSO4 khan là chất bột màu trắng.
a. Dung dịch CuSO4 tạo kết tủa màu xanh khi cho tác dụng với dung dịch NaOH.
b. Khi hòa tan vào nước, dung dịch CuSO4 có màu xanh lam.
c. Muối CuSO4 khan hấp thụ nước chuyển thành dạng hydrate có công thức là CuSO4.2H2O.
d. Nhỏ từ từ đến dư dung dịch NH3 vào dung dịch CuSO4 thu được kết tủa màu xanh lam.
Hướng dẫn giải
a. Đúng.
b. Đúng.
c. Sai vì muối CuSO4 khan hấp thụ nước chuyển thành dạng hydrate có công thức là CuSO4.5H2O.
d. Sai vì khi nhỏ từ từ đến dư dung dịch NH3 vào dung dịch CuSO4 ban đầu thu được kết tủa màu xanh lam, sau đó kết tủa tan tạo thành dung dịch phức chất màu xanh thẫm.
Câu 12. Tiến hành thí nghiệm sau:
Bước 1: Cho vào ống nghiệm thứ nhất 10 ml dung dịch CuSO4 0,1 M, ống nghiệm thứ hai 10 ml FeCl3 0,1 M.
Bước 2: Nhỏ khoảng 4−6 giọt dung dịch NaOH 0,1 M vào 2 ống nghiệm.
Phát biểu nào sau đây đúng?
a. Ở cả 2 ống nghiệm dung dịch không màu.
b. Ở cả 2 ống nghiệm đều xuất hiện kết tủa trắng.
c. Ống nghiệm thứ xuất có kết tủa màu xanh lam, ống nghiệm thứ 2 có kết tủa màu nâu đỏ.
d. Ống nghiệm thứ xuất có kết tủa màu nâu đỏ, ống nghiệm thứ 2 có kết tủa màu xanh lam.
Hướng dẫn giải
a. Sai vì khi nhỏ NaOH vào CuSO4 và FeCl3, sẽ xuất hiện kết tủa. Ống CuSO4 sẽ có kết tủa màu xanh lam (Cu(OH)2) và ống FeCl3 sẽ có kết tủa màu nâu đỏ (Fe(OH)3).
b. Sai vì kết tủa Cu(OH)2 có màu xanh lam và Fe(OH)3 có màu nâu đỏ, không phải kết tủa trắng.
c. Đúng.
d. Sai vì ống thứ nhất sẽ có kết tủa màu xanh lam (Cu(OH)2) và ống thứ hai sẽ có kết tủa màu nâu đỏ (Fe(OH)3).
Câu 13. Muối Mohr có công thức (NH4)2Fe(SO4)2.6H2O. Để xác định độ tinh khiết của một loại muối Mohr (Cho rằng trong muối Mohr chỉ có muối kép ngậm nước nêu trên và tạp chất trơ), một học sinh tiến hành các thí nghiệm sau: Cân chính xác 7,237 gam muối Mohr, pha thành 100 mL dung dịch X. Lấy chính xác 10 mL dung dịch X, thêm 10 mL dung dịch H2SO4 10%, được dung dịch Y. Chuẩn độ dung dịch Y bằng dung dịch chuẩn KMnO4 0,023M. Thực hiện chuẩn độ 3 lần. Kết quả đạt được như sau:
|
Lần chuẩn độ |
1 |
2 |
3 |
|
V dung dịch KMnO4 (ml) |
16,0 |
16,1 |
16,0 |
Theo kết quả chuẩn độ ở trên, hãy tính độ tinh khiết (% khối lượng (NH4)2Fe(SO4)2.6H2O) của muối Mohr? (Làm tròn kết quả đến hàng phần mười)
Hướng dẫn giải
Đáp số: 99,7.
Giải thích:
Vtrung bình = = 16,0333 (mL).
Phương trình phản ứng hóa học:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Trong 100 mL dd X chứa:
Câu 14. Cu có số hiệu nguyên tử là 29. Nguyên tử Cu có bao nhiêu electron trên phân lớp 3d?
Hướng dẫn giải
Đáp số: 10.
Giải thích:
Cấu hình electron của 1s22s22p63s23p63d104s1.
Câu 15. Xác định độ tinh khiết của 1 mẫu quặng hematite (Fe2O3) biết rằng trong 5 kg quặng chứa 2,78 kg sắt. (Làm tròn kết quả đến hàng phần mười).
Hướng dẫn giải
Đáp số: 79,4.
Giải thích:
nFe = ⟶ ⟶
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 22: Sự ăn mòn kim loại
Lý thuyết Bài 24: Nguyên tố nhóm IA
Lý thuyết Bài 25: Nguyên tố nhóm IIA
Lý thuyết Bài 27: Đại cương về kim loại chuyển tiếp dãy thứ nhất
Lý thuyết Bài 28: Sơ lược về phức chất
Lý thuyết Bài 29: Một số tính chất và ứng dụng của phức chất