1. Giải bài 1 trang 44 SGK Hóa 12
Có 3 hóa chất sau đây: Etylamin, phenylamin và amoniac. Thứ tự tăng dần lực bazơ được xếp theo dãy:
A. amoniac < etylamin < phenylamin
B. etylamin < amoniac < phenylamin
C. phenylamin < amoniac < etylamin
D. phenylamin < etylamin < amoniac
Phương pháp giải
Để so sánh lực bazơ của các chất, cần nắm nguyên tắc sau:
– Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ. Càng nhiều gốc đẩy e thì tính bazơ càng mạnh và ngược lại càng nhiều gốc hút e thì tính bazơ càng yếu.
– Do đó ta có thứ tự tính bazơ tăng dần như sau:
+ Amin bậc III hút e < amin bậc II hút e < amin bậc I hút e < NH3 < amin bậc I đẩy e < amin bậc II đẩy e < amin bậc III đẩy e
+ Nhóm đẩy:
- Những gốc ankyl (gốc hyđrocacbon no): CH3–, C2H5–, iso propyl …
- Các nhóm còn chứa cặp e chưa liên kết: -OH (còn 2 cặp), -NH2 (còn 1 cặp)….
+ Nhóm hút:
- Tất cả các nhóm có chứa liên kết π, vì liên kết π hút e rất mạnh.
- Những gốc hyđrocacbon không no: CH2=CH-, CH2=CH−CH2– …
- Những nhóm khác chứa nối đôi như: -COOH (cacboxyl), -CHO (anđehit), -CO- (cacbonyl), -NO2 (nitro), ….
- Các nguyên tố có độ âm điện mạnh: -Cl, -Br, -F (halogen)…
Hướng dẫn giải
Thứ tự tăng dần lực bazơ được xếp theo dãy: phenylamin < amoniac < etylamin
→ Đáp án C.
2. Giải bài 2 trang 44 SGK Hóa 12
Có thể nhận biết lọ đựng dung dịch CH3NH2 bằng cách nào trong các cách sau?
A. Nhận biết bằng mùi
B. Thêm vài giọt dung dịch H2SO4
C. Thêm vài giọt dung dịch Na2CO3
D. Đưa đũa thủy tinh đã nhúng vào dung dịch HCl đậm đặc lên phía trên miệng lọ đựng dung dịch CH3NH2 đặc
Phương pháp giải
Để nhận biết lọ đựng dung dịch CH3NH2 ta dựa vào tính chất hóa học đặc trưng để chọn phương pháp phù hợp.
Hướng dẫn giải
Khi cho CH3NH2 tác dụng với dung dịch HCl đặc ta thấy xung quanh xuất hiện khói trắng. Khói trắng tạo thành là muối amoni.
CH3NH2 + HCl → CH3NH3Cl
Dựa vào đó nhận biết được CH3NH2.
→ Đáp án D.
3. Giải bài 3 trang 44 SGK Hóa 12
Viết công thức cấu tạo, gọi tên và chỉ rõ bậc của từng amin đồng phân có công thức phân tử sau:
a) C3H9N
b) C7H9N (chứa vòng benzen)
Phương pháp giải
Để phân biệt các dung dịch trên cần nắm được đặc điểm cấu tạo của các chất → tính chất hóa học khác nhau → chọn thuốc thử thích hợp.
Hướng dẫn giải
Câu a: Công thức cấu tạo và tên gọi C3H9N
CH3-CH2-CH2-NH2: propylamin (amin bậc một)
\(\begin{matrix} CH_{3} – CH – NH_{2} \\ ^| \ \ \ \\ CH_{3} \end{matrix}\): isopropylamin (amin bậc một)
CH3-CH2-NH-CH3: etylmetylamin (amin bậc hai)
\(\begin{matrix} CH_{3} \\ ^| \\ CH_{3}-N-CH_{3} \end{matrix}\): trimetylamin (amin bậc ba)
Câu b: Công thức cấu tạo và tên gọi C7H9N
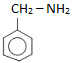 : benzylamin (amin bậc một)
: benzylamin (amin bậc một)
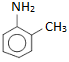 : o-metylanilin (amin bậc một)
: o-metylanilin (amin bậc một)
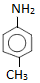 : p-metylanilin (amin bậc một)
: p-metylanilin (amin bậc một)
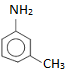 : m-metylanilin (amin bậc một)
: m-metylanilin (amin bậc một)
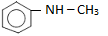 : metylphenylamin (amin bậc hai).
: metylphenylamin (amin bậc hai).
4. Giải bài 4 trang 44 SGK Hóa 12
Trình bày phương pháp hóa học để tách riêng từng chất trong mỗi hỗn hợp sau đây:
a) Hỗn hợp khí: CH4 và CH3NH2
b) Hỗn hợp lỏng: C6H6, C6H5OH và C6H5NH2
Phương pháp giải
Để tách riêng từng chất trong mỗi hỗn hợp, ta cần nắm được đặc điểm cấu tạo từng chất → tính chất hóa học của từng chất → chọn thuốc thử cho phù hợp.
Hướng dẫn giải
Câu a: Phương pháp hóa học để tách riêng CH4 và CH3NH2
Sục hỗn hợp khí qua dung dịch HCl dư thu được khí CH4. Do HCl phản ứng với metyl amin.
CH3NH2 + HCl → CH3NH3Cl
Dung dịch thu được sau phản ứng cho tác dụng với dung dịch NaOH dư thu lại được metylamin.
CH3-NH3Cl + NaOH → CH3-NH2 + NaCl + H2O
Câu b: Phương pháp hóa học để tách riêng C6H6, C6H5OH và C6H5NH2
- Đổ dung dịch HCl loãng vào hỗn hợp chất lỏng, khuấy đều. Anilin phản ứng tạo muối C6H5-NH3Cl tan vào dung dịch HCl nằm bên dưới.
- Chiết tách phần dung dịch phía dưới ra, cho NaOH dư vào thu anilin nổi lên trên không tan.
C6H5-NH2 + HCl → C6H5-NH3Cl
C6H5-NH3Cl + NaOH → C6H5-NH2 + NaCl + H2O
Phần phenol và benzen tách ra ở trên cho vào dung dịch NaOH khuấy đều.
- Phenol phản ứng tạo muối phenolat tan vào dung dịch NaOH, benzen không tan nổi bên trên được chiết tách ra.
C6H5-OH + NaOH → C6H5-ONa + H2O
- Cho dung dịch muối phenolat vào dung dịch HCl dư. Phenol bị đẩy ra kết tủa lắng xuống, lọc tủa thu phenol.
C6H5-ONa + HCl → C6H5-OH + NaCl
5. Giải bài 5 trang 44 SGK Hóa 12
Hãy tìm phương pháp hóa học để giải quyết hai vấn đề sau:
a) Rửa lọ đã đựng anilin.
b) Khử mùi tanh của cá sau khi mổ để nấu. Biết rằng mùi tanh của cá (đặc biệt là cá mè) là do hỗn hợp một số amin (nhiều nhất là trimetylamin) và một số chất khác gây nên.
Phương pháp giải
Để giải quyết được vấn đề đặt ra ở đề bài, cần nắm được tính chất hóa học đặc trưng của các chất nhưng không gây độc hại, từ đó đưa ra phương pháp phù hợp.
Hướng dẫn giải
Câu a: Phương pháp hóa học để rửa lọ đã đựng anilin
Cho vào lọ đựng anilin dung dịch HCl sau đó tráng bằng nước cất.
C6H5NH2 + HCl → C6H5NH3Cl
Câu b: Phương pháp hóa học để khử mùi tanh của cá sau khi mổ để nấu
Ta cho vào một ít giấm CH3COOH các amin sẽ tạo muối với CH3COOH nên không còn tanh nữa.
(CH3)3N + CH3COOH → CH3COONH(CH3)3
6. Giải bài 6 trang 44 SGK Hóa 12
a) Tính thể tích nước brom 3% (D = 1,3 g/ml) cần dùng để điều chế 4,4 gam tribromanilin?
b) Tính khối lượng anilin có trong dung dịch A. Biết khi cho A tác dụng với nước brom thì thu được 6,6 gam kết tủa trắng?
Giả thiết rằng hiệu suất phản ứng của cả hai trường hợp trên là 100%
Phương pháp giải
Để tính các đại lượng theo yêu cầu đề bài, ta dựa vào phương trình hóa học.
Hướng dẫn giải
Câu a: Thể tích nước brom 3% (D = 1,3 g/ml) cần dùng để điều chế 4,4 gam tribromanilin
ntribromanilin= 4,4/330 = 1/75 (mol)
Ta có phương trình hóa học:
C6H5NH2 + 3Br2 → C6H2Br3NH2↓ + 3HBr (1)
3 mol 1 mol
x mol 1/75 mol
→ x = 3.1/75 = 0,04 (mol)
Dựa vào phương trình ta tính được:
\(\begin{array}{l} {m_{B{r_2}}} = 0,04.160 = 6.4g\\ {m_{ddB{r_2}}} = \frac{{6,4.100}}{3} = \frac{{640}}{3}g\\ {V_{dd\;B{r_2}}} = \frac{{{m_{ddB{r_2}}}}}{D} = \frac{{640}}{{3.1,3}} = 164,1\;(ml) \end{array}\)
Câu b: Khối lượng anilin có trong dung dịch A
Ta có phương trình:
C6H5NH2 + 3 Br2 → C6H2Br3NH2↓ + 3 HBr (2)
93 gam 330 gam
y gam 6,6 gam
Dựa vào PTHH ta tính được:
⇒ y = (93.6,6)/330 = 1,86
y = manilin = (93.6,6)/330 = 1,86 (gam).
